题目内容
如图所示的装置,X、Y都是惰性电极.将电源接通后,向(甲)中滴入酚酞溶液,在Fe极附近显红色.试回答下列问题:
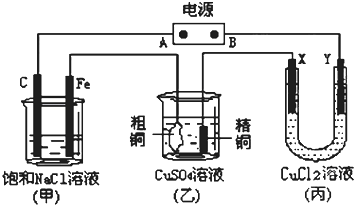
(1)在电源中,B电极为 极(填电极名称,下同);丙装置中Y电极为 极.
(2)在甲装置中,石墨(C)电极上发生 反应(填“氧化”或“还原”);甲装置中总的化学方程式是: .
(3)丙装置在通电一段时间后,X电极上发生的电极反应式是 .
(4)如果乙装置中精铜电极的质量增加了0.64g,请问甲装置中,铁电极上产生的气体在标准状况下为
L.

(1)在电源中,B电极为
(2)在甲装置中,石墨(C)电极上发生
(3)丙装置在通电一段时间后,X电极上发生的电极反应式是
(4)如果乙装置中精铜电极的质量增加了0.64g,请问甲装置中,铁电极上产生的气体在标准状况下为
考点:原电池和电解池的工作原理
专题:电化学专题
分析:(1)电解饱和食盐水时,酚酞变红的极是阴极,阴极和电源负极相连,则在Fe极附近显红色,所以Fe是阴极,A是正极、B是负极,X是阳极,Y是阴极,
(2)根据电解池的工作原理以及电极反应来回答;
(3)在电解池的阴极上是电解质中的阳离子发生得电子的还原反应;
(4)根据串联电路中转移电子是相等的电子守恒规律来计算即可.
(2)根据电解池的工作原理以及电极反应来回答;
(3)在电解池的阴极上是电解质中的阳离子发生得电子的还原反应;
(4)根据串联电路中转移电子是相等的电子守恒规律来计算即可.
解答:
解:电解饱和食盐水时,酚酞变红的极是阴极,阴极和电源负极相连,则在Fe极附近显红色,所以Fe是阴极,A是正极、B是负极,X是阳极,Y是阴极
(1)在Fe极附近显红色,所以Fe是阴极,A是正极、B是负极,X是阳极,Y是阴极,
故答案为:负;阴,
(2)在甲装置中,石墨(C)电极是阳极,该电极上发生氧化反应,电解饱和食盐水的反应原理是:2NaCl+2H2O
2NaOH+H2↑+Cl2↑,
故答案为:氧化;2NaCl+2H2O
2NaOH+H2↑+Cl2↑;
(3)丙中X是阳极,阳极上是电解质中的阴离子氯离子失电子发生氧化反应,即2Cl--2e-=Cl2↑,
故答案为:2Cl--2e-=Cl2↑;
(4)乙装置中精铜电极的质量增加了0.64g,根据电极反应:Cu2++2e-=Cu,即生成0.64g即0.01mol铜,转移电子是0.02mol,铁电极是阴极,该极上产生氢气,2H++2e-=H2↑,当转移0.02mol电子时,该极上产生的气体为0.01mol,在标准状况下体积为0.224L,
故答案为:0.224.
(1)在Fe极附近显红色,所以Fe是阴极,A是正极、B是负极,X是阳极,Y是阴极,
故答案为:负;阴,
(2)在甲装置中,石墨(C)电极是阳极,该电极上发生氧化反应,电解饱和食盐水的反应原理是:2NaCl+2H2O
| ||
故答案为:氧化;2NaCl+2H2O
| ||
(3)丙中X是阳极,阳极上是电解质中的阴离子氯离子失电子发生氧化反应,即2Cl--2e-=Cl2↑,
故答案为:2Cl--2e-=Cl2↑;
(4)乙装置中精铜电极的质量增加了0.64g,根据电极反应:Cu2++2e-=Cu,即生成0.64g即0.01mol铜,转移电子是0.02mol,铁电极是阴极,该极上产生氢气,2H++2e-=H2↑,当转移0.02mol电子时,该极上产生的气体为0.01mol,在标准状况下体积为0.224L,
故答案为:0.224.
点评:本题以电解池原理为载体考查了正负极的判断、电极反应式的书写等知识点,难度中等,明确溶液中离子的放电顺序是解本题的关键.

练习册系列答案
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
下面是生产生活中的常见有机物的分子式、结构式、结构简式或名称有关说法正确的是( )
① ②
② ③
③ ④
④ ⑤CH3CH2OH⑥C6H12O6⑦CH3COOH
⑤CH3CH2OH⑥C6H12O6⑦CH3COOH
⑧硬脂酸甘油酯、⑨蛋白质、⑩聚乙烯.
①
 ②
② ③
③ ④
④ ⑤CH3CH2OH⑥C6H12O6⑦CH3COOH
⑤CH3CH2OH⑥C6H12O6⑦CH3COOH⑧硬脂酸甘油酯、⑨蛋白质、⑩聚乙烯.
| A、能跟溴的四氯化碳溶液发生加成反应并使之褪色的有①②④⑩ |
| B、投入钠能产生H2的是⑤⑦⑧⑨ |
| C、属于高分子材料的是⑧⑨⑩ |
| D、含碳量最高、有毒、常温下为液体且点燃时有浓烟的是① |
在氧化还原反应中,下列叙述正确的是( )
| A、物质失电子的反应为还原反应 |
| B、物质在变化中得到电子,此物质是还原剂 |
| C、发生电子转移的反应即是氧化还原反应 |
| D、发生化合价升降的反应一定是氧化还原反应 |
化学与生活、生产联系密切,下列说法不正确的是( )
| A、生石灰、铁粉常用于食品干燥剂 |
| B、“地沟油”经过加工处理后可用来制肥皂 |
| C、抗酸药如小苏打可治疗因胃酸过多引起的消化不良 |
| D、以粮食为原料酿酒过程的变化包括粮食一淀粉一葡萄糖一乙醇 |
 一定条件下,在2L的密闭容器中,发生下述反应:N2(g)+3H2(g)?2NH3(g)△H=-92.4KJ/mol
一定条件下,在2L的密闭容器中,发生下述反应:N2(g)+3H2(g)?2NH3(g)△H=-92.4KJ/mol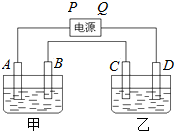 已知A、B、C、D都是铂电极,P、Q是直流电源的两极,通电后发现B极质量增加.
已知A、B、C、D都是铂电极,P、Q是直流电源的两极,通电后发现B极质量增加.
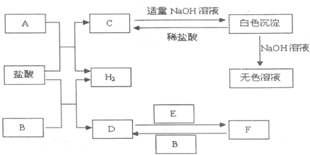 下列物质A~F是我们熟悉的单质或化合物,其中A、E均为C中元素形成的单质,B是常见的金属,且B的合金用量最大;在适当的条件下,它们之间可以发生如图所示的转化.
下列物质A~F是我们熟悉的单质或化合物,其中A、E均为C中元素形成的单质,B是常见的金属,且B的合金用量最大;在适当的条件下,它们之间可以发生如图所示的转化.