题目内容
某同学用下列各装置设计一个实验,验证氯气的性质.
请回答:
(1)②中浓硫酸的作用是 ;
(2)③中的实验现象是 ;④中的实验现象是 ;上述实验现象说明起漂白作用的是 (填化学式).
(3)⑤中NaOH溶液的作用是吸收多余的氯气、防止污染大气,试写出反应的离子方程式: .

请回答:
(1)②中浓硫酸的作用是
(2)③中的实验现象是
(3)⑤中NaOH溶液的作用是吸收多余的氯气、防止污染大气,试写出反应的离子方程式:
考点:氯、溴、碘的性质实验,氯气的实验室制法
专题:实验题
分析:该实验是气体通过浓硫酸干燥氯气,干燥的氯气通入②,不能使干燥的有色布条褪色,再通入湿润的有色布条,布条褪色,证明干燥氯气不具有漂白性,氯气和水反应生成盐酸和次氯酸,方程式为:Cl2+H2O=HCl+HClO,次氯酸具有漂白性,氯气有毒,应进行尾气处理,不能随意排放到空气中,可用碱溶液来吸收:Cl2+2NaOH=NaCl+NaClO+H2O.
解答:
解:(1)浓硫酸具有吸水性,常用作干燥剂,在实验中吸收气体a中的水蒸气,
故答案为:除去氯气中的水蒸气,干燥氯气;
(2)干燥氯气不具有漂白性,氯气和水反应生成盐酸和次氯酸,方程式为:Cl2+H2O=HCl+HClO,次氯酸具有漂白性,
故答案为:有色布条不褪色;湿润有色布条褪色;次氯酸;
(3)氯气可用碱溶液来吸收:Cl2+2NaOH=NaCl+NaClO+H2O,离子方程式为:Cl2+2OH-=Cl-+ClO-+H20,
故答案为:Cl2+2OH-=Cl-+ClO-+H20.
故答案为:除去氯气中的水蒸气,干燥氯气;
(2)干燥氯气不具有漂白性,氯气和水反应生成盐酸和次氯酸,方程式为:Cl2+H2O=HCl+HClO,次氯酸具有漂白性,
故答案为:有色布条不褪色;湿润有色布条褪色;次氯酸;
(3)氯气可用碱溶液来吸收:Cl2+2NaOH=NaCl+NaClO+H2O,离子方程式为:Cl2+2OH-=Cl-+ClO-+H20,
故答案为:Cl2+2OH-=Cl-+ClO-+H20.
点评:本题考查氯气的性质,氯气没有漂白性,氯水的漂白性是溶液中次氯酸的表现的性质.

练习册系列答案
相关题目
有机化学中取代反应的范畴很广.下列4个反应中,不属于取代反应范畴的是( )
A、 | |||
B、CH3CH2CH2CHOHCH3
| |||
C、2CH3CH2OH
| |||
D、CH3COOH+CH3OH
|
下面是生产生活中的常见有机物的分子式、结构式、结构简式或名称有关说法正确的是( )
① ②
② ③
③ ④
④ ⑤CH3CH2OH⑥C6H12O6⑦CH3COOH
⑤CH3CH2OH⑥C6H12O6⑦CH3COOH
⑧硬脂酸甘油酯、⑨蛋白质、⑩聚乙烯.
①
 ②
② ③
③ ④
④ ⑤CH3CH2OH⑥C6H12O6⑦CH3COOH
⑤CH3CH2OH⑥C6H12O6⑦CH3COOH⑧硬脂酸甘油酯、⑨蛋白质、⑩聚乙烯.
| A、能跟溴的四氯化碳溶液发生加成反应并使之褪色的有①②④⑩ |
| B、投入钠能产生H2的是⑤⑦⑧⑨ |
| C、属于高分子材料的是⑧⑨⑩ |
| D、含碳量最高、有毒、常温下为液体且点燃时有浓烟的是① |
镍氢电池的总反应为 H2+2NiO(OH)
2Ni(OH)2,根据此反应式判断,此电池放电时,正极上发生反应的物质是( )
| 放电 |
| 充电 |
| A、NiO(OH) |
| B、Ni(OH)2 |
| C、H2 |
| D、H2和NiO(OH) |
下列关于氯水的说法中,不正确的是( )
| A、新制氯水具有漂白作用 |
| B、新制氯水呈黄绿色 |
| C、新制氯水应避光保存 |
| D、氯水是指液态的氯 |
在氧化还原反应中,下列叙述正确的是( )
| A、物质失电子的反应为还原反应 |
| B、物质在变化中得到电子,此物质是还原剂 |
| C、发生电子转移的反应即是氧化还原反应 |
| D、发生化合价升降的反应一定是氧化还原反应 |
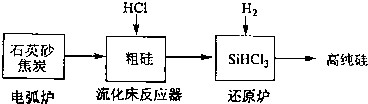
 一定条件下,在2L的密闭容器中,发生下述反应:N2(g)+3H2(g)?2NH3(g)△H=-92.4KJ/mol
一定条件下,在2L的密闭容器中,发生下述反应:N2(g)+3H2(g)?2NH3(g)△H=-92.4KJ/mol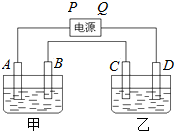 已知A、B、C、D都是铂电极,P、Q是直流电源的两极,通电后发现B极质量增加.
已知A、B、C、D都是铂电极,P、Q是直流电源的两极,通电后发现B极质量增加.