题目内容
氯气是制取漂白粉和漂粉精的原料,但是一种有毒气体.某同学用如图所示装置获得干燥的氯气(发生装置已略去).请按要求回答下列问题.

(1)图装置并不完善,请在方框内画出D的装置图,并注明试剂名称.
(2)欲除去Cl2中的HCl,装置A中应选用的试剂为 .
a.饱和氢氧化钠溶液 b.饱和食盐水 c.饱和氨水
(3)装置B中盛放的是浓硫酸,作用是 .
(4)假设C中收集到V L(标准状况下)Cl2,与过量消石灰完全反应,所得漂白粉中有效成分Ca(ClO)2的质量为(用含V的代数式表示) g.
(5)现有一瓶不含Ca(OH)2的密封不严的漂粉精,为确定该样品中除CaCl2外的其他固体物质X的成分,某同学进行了如下探究活动:
I.提出合理假设
假设一:该漂粉精没有变质,X只含 ;
假设二:该漂粉精全部变质,X只含CaCO3;
假设三:该漂粉精部分变质,X含有以上两种物质.
Ⅱ.设计实验方案,进行实验
请写出下表中空缺的实验步骤、预期现象和相应结论:(限选用的药品:蒸馏水、1mol/L盐酸、澄清石灰水、品红溶液)

(1)图装置并不完善,请在方框内画出D的装置图,并注明试剂名称.
(2)欲除去Cl2中的HCl,装置A中应选用的试剂为
a.饱和氢氧化钠溶液 b.饱和食盐水 c.饱和氨水
(3)装置B中盛放的是浓硫酸,作用是
(4)假设C中收集到V L(标准状况下)Cl2,与过量消石灰完全反应,所得漂白粉中有效成分Ca(ClO)2的质量为(用含V的代数式表示)
(5)现有一瓶不含Ca(OH)2的密封不严的漂粉精,为确定该样品中除CaCl2外的其他固体物质X的成分,某同学进行了如下探究活动:
I.提出合理假设
假设一:该漂粉精没有变质,X只含
假设二:该漂粉精全部变质,X只含CaCO3;
假设三:该漂粉精部分变质,X含有以上两种物质.
Ⅱ.设计实验方案,进行实验
请写出下表中空缺的实验步骤、预期现象和相应结论:(限选用的药品:蒸馏水、1mol/L盐酸、澄清石灰水、品红溶液)
| 实验步骤 | 预期现象和相应结论 | |
| i |  试管B中的试剂为澄清石灰水.向试管A中滴入盐酸. 试管B中的试剂为澄清石灰水.向试管A中滴入盐酸. |
①若 ②若 |
| ii | 若“假设一”不成立,向实验步骤i反应后的试管A中滴入2滴 |
①若 中的②分析,则“假设三”成立. ②若 |
考点:氯、溴、碘的性质实验
专题:实验题,卤族元素
分析:(1)因氯气有毒,气体不能排放到空气中,可用氢氧化钠溶液吸收,则丁应为尾气处理装置,装置图为 ;
;
(2)因氯气难溶于饱和食盐水,氯化氢极易溶于水,则除去Cl2中的HCl可通过饱和食盐水;
(3)浓硫酸可干燥氯气;
(4)根据方程式2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O计算;
(5)a未变质时为次氯酸钙,完全变质时为碳酸钙;
b取少量上述漂白粉于试管中,加入适量1mol/L盐酸溶解后,再将产生的气体导入到足量的澄清石灰水中,根据是否有沉淀生成判断假设的正误,向步骤①反应后的试管滴入1~2滴品红溶液,振荡,根据品红是否褪色判断固体中是否存在Ca(ClO)2.
 ;
;(2)因氯气难溶于饱和食盐水,氯化氢极易溶于水,则除去Cl2中的HCl可通过饱和食盐水;
(3)浓硫酸可干燥氯气;
(4)根据方程式2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O计算;
(5)a未变质时为次氯酸钙,完全变质时为碳酸钙;
b取少量上述漂白粉于试管中,加入适量1mol/L盐酸溶解后,再将产生的气体导入到足量的澄清石灰水中,根据是否有沉淀生成判断假设的正误,向步骤①反应后的试管滴入1~2滴品红溶液,振荡,根据品红是否褪色判断固体中是否存在Ca(ClO)2.
解答:
解:(1)实验室制备氯气,因氯气有毒,气体不能排放到空气中,可用氢氧化钠溶液吸收,则丁应为尾气处理装置,装置图为 ,
,
故答案为: ;
;
(2)因氯气难溶于饱和食盐水,则可先将气体通过饱和食盐水,故答案为:b;
(3)通过盛有浓硫酸的洗气瓶,可得到干燥的氯气,故答案为:干燥氯气;
(4)设所得漂白粉中有效成分Ca(ClO)2的质量为x
2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O
44.8L 143g
VL x
解得:x=
,故答案为:
;
(5)a漂白粉的主要成分是CaCl2、Ca(ClO)2,除CaCl2外,如果漂白粉没有变质,则一定含有Ca(Cl0)2,由于在空气中发生:Ca(Cl0)2+CO2+H2O=CaCO3+2HClO,如漂白粉全部变质,则含有CaCO3,如漂白粉部分变质,则既含有Ca(ClO)2又含有CaC03,故答案为:Ca(Cl0)2;
b取少量上述漂白粉于试管中,加入适量1mol/L盐酸溶解后,再将产生的气体导入到,足量的澄清石灰水中,①若澄清石灰水未见浑浊,则假设1成立,
②若澄清石灰水变浑浊,则假设2或3成立,
向步骤①反应后的试管滴入1~2滴品红溶液,振荡,若品红褪色,固体中存在 Ca(ClO)2;若品红不褪色,则固体中不存在 Ca(ClO)2.
故答案为:
 ,
,故答案为:
 ;
;(2)因氯气难溶于饱和食盐水,则可先将气体通过饱和食盐水,故答案为:b;
(3)通过盛有浓硫酸的洗气瓶,可得到干燥的氯气,故答案为:干燥氯气;
(4)设所得漂白粉中有效成分Ca(ClO)2的质量为x
2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O
44.8L 143g
VL x
解得:x=
| 715V |
| 224 |
| 715V |
| 224 |
(5)a漂白粉的主要成分是CaCl2、Ca(ClO)2,除CaCl2外,如果漂白粉没有变质,则一定含有Ca(Cl0)2,由于在空气中发生:Ca(Cl0)2+CO2+H2O=CaCO3+2HClO,如漂白粉全部变质,则含有CaCO3,如漂白粉部分变质,则既含有Ca(ClO)2又含有CaC03,故答案为:Ca(Cl0)2;
b取少量上述漂白粉于试管中,加入适量1mol/L盐酸溶解后,再将产生的气体导入到,足量的澄清石灰水中,①若澄清石灰水未见浑浊,则假设1成立,
②若澄清石灰水变浑浊,则假设2或3成立,
向步骤①反应后的试管滴入1~2滴品红溶液,振荡,若品红褪色,固体中存在 Ca(ClO)2;若品红不褪色,则固体中不存在 Ca(ClO)2.
故答案为:
| 实验步骤 | 预期现象和结论 | |
| ① | 加入适量的1mol/L盐酸溶解后,将产生的气体通入足量的澄清石灰水中 | (1)若澄清石灰水未见浑浊,则假设一成立 (2)若澄清石灰水变浑浊,则假设二或三成立 |
| ② | 向步骤①反应后的试管滴入1~2滴品红溶液,振荡 | (1)若品红褪色,固体中存在 Ca(ClO)2,假设三成立;(2)若品红不褪色,则固体中不存在 Ca(ClO)2,假设二成立; |
| ③ | ||
点评:本题考查卤素化合物的性质及应用,题目难度中等,本题易错点为(5),注意根据Ca(Cl0)2、CaCO3的性质设计实验方案.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列关于氯水的说法中,不正确的是( )
| A、新制氯水具有漂白作用 |
| B、新制氯水呈黄绿色 |
| C、新制氯水应避光保存 |
| D、氯水是指液态的氯 |
下列对有机物结构或性质的描述,错误的是( )
| A、1-溴丙烷与2-溴丙烷发生消去反应的产物不相同 |
| B、苯、甲苯在一定条件下均能发生取代反应 |
| C、通过红外光谱分析可以区分CH3CH2OH和CH3OCH3 |
D、异戊二烯( )与等物质的量的溴单质反应,产物只有一种 )与等物质的量的溴单质反应,产物只有一种 |
 一定条件下,在2L的密闭容器中,发生下述反应:N2(g)+3H2(g)?2NH3(g)△H=-92.4KJ/mol
一定条件下,在2L的密闭容器中,发生下述反应:N2(g)+3H2(g)?2NH3(g)△H=-92.4KJ/mol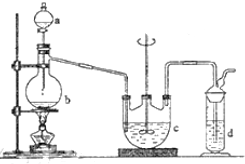 硫代硫酸钠(Na2S2O3)可用做分析试剂及鞣革还原剂.它受热、遇酸易分解.工业上可用反应:2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2制得.实验室模拟该工业过程的装置如图所示.回答下列问题:
硫代硫酸钠(Na2S2O3)可用做分析试剂及鞣革还原剂.它受热、遇酸易分解.工业上可用反应:2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2制得.实验室模拟该工业过程的装置如图所示.回答下列问题: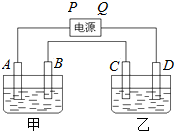 已知A、B、C、D都是铂电极,P、Q是直流电源的两极,通电后发现B极质量增加.
已知A、B、C、D都是铂电极,P、Q是直流电源的两极,通电后发现B极质量增加.