题目内容
NA为阿伏加德罗常数的数值,下列说法中正确的是( )
| A、在密闭容器中加入1.5molH2和0.5molN2,充分反应后可得NH3分子数目为NA |
| B、足量的铁粉与lmolCl2在加热条件下充分反应,转移的电子数为3NA |
| C、标准状况下,等物质的量的N2和CO所含分子数均为NA |
| D、7.8 g Na2O2中含有的离子总数目为0.3NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.合成氨的反应为可逆反应,反应物不可能完全转化成生成物氨气;
B.铁粉过量,转移的电子数目需要按照氯气的物质的量进行计算;
C.没有告诉氮气和一氧化碳的物质的量,无法计算氮气和一氧化碳的分子数;
D.过氧化钠中含有的阳离子为过氧根离子,7.8g过氧化钠的物质的量为:
=0.1mol,0.1mol过氧化钠中含有0.2mol钠离子和0.1mol过氧根离子.
B.铁粉过量,转移的电子数目需要按照氯气的物质的量进行计算;
C.没有告诉氮气和一氧化碳的物质的量,无法计算氮气和一氧化碳的分子数;
D.过氧化钠中含有的阳离子为过氧根离子,7.8g过氧化钠的物质的量为:
| 7.8g |
| 78g/mol |
解答:
解:A.在密闭容器中加入1.5molH2和0.5molN2,该反应可逆反应,充分反应后生成氨气的物质的量小于1mol,可得NH3分子数目小于NA,故A错误;
B.足量的铁粉与lmolCl2在加热条件下充分反应,1mol氯气完全反应得到2mol电子,转移的电子数为2NA,故B错误;
C.缺少气体的物质的量,无法计算氮气和一氧化碳气体的分子数,故C错误;
D.7.8g过氧化钠的物质的量为:
=0.1mol,0.1mol过氧化钠中含有0.2mol钠离子和0.1mol过氧根离子,总共含有0.3mol离子,含有的离子总数目为0.3NA,故D正确;
故选D.
B.足量的铁粉与lmolCl2在加热条件下充分反应,1mol氯气完全反应得到2mol电子,转移的电子数为2NA,故B错误;
C.缺少气体的物质的量,无法计算氮气和一氧化碳气体的分子数,故C错误;
D.7.8g过氧化钠的物质的量为:
| 7.8g |
| 78g/mol |
故选D.
点评:本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意过氧化钠中阴离子为过氧根离子,要求学生掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,选项C为易错点,注意题中缺少气体的物质的量.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
某液态烃和溴水发生加成反应生成2,3-二溴-2-甲基丁烷,则该烃是( )
| A、3-甲基-1-丁烯 |
| B、2-甲基-2-丁烯 |
| C、2-甲基-1-丁烯 |
| D、1-甲基-2-丁烯 |
有机化学中取代反应的范畴很广.下列4个反应中,不属于取代反应范畴的是( )
A、 | |||
B、CH3CH2CH2CHOHCH3
| |||
C、2CH3CH2OH
| |||
D、CH3COOH+CH3OH
|
关于反应2Na2O2+2CO2=2Na2CO3+O2↑ 的说法正确的是( )
| A、该反应的还原剂是CO2 |
| B、该反应的氧化剂是Na2O2,发生氧化反应 |
| C、氧化剂和还原剂的物质的质量比为39:22 |
| D、若有2 mol Na2O2参加反应,则转移电子2 mol |
可逆反应达到平衡的重要特征是( )
| A、反应停止了 |
| B、正、逆反应的速率相等 |
| C、反应物和生成物的浓度相等 |
| D、正、逆反应速率都为零 |
下面是生产生活中的常见有机物的分子式、结构式、结构简式或名称有关说法正确的是( )
① ②
② ③
③ ④
④ ⑤CH3CH2OH⑥C6H12O6⑦CH3COOH
⑤CH3CH2OH⑥C6H12O6⑦CH3COOH
⑧硬脂酸甘油酯、⑨蛋白质、⑩聚乙烯.
①
 ②
② ③
③ ④
④ ⑤CH3CH2OH⑥C6H12O6⑦CH3COOH
⑤CH3CH2OH⑥C6H12O6⑦CH3COOH⑧硬脂酸甘油酯、⑨蛋白质、⑩聚乙烯.
| A、能跟溴的四氯化碳溶液发生加成反应并使之褪色的有①②④⑩ |
| B、投入钠能产生H2的是⑤⑦⑧⑨ |
| C、属于高分子材料的是⑧⑨⑩ |
| D、含碳量最高、有毒、常温下为液体且点燃时有浓烟的是① |
镍氢电池的总反应为 H2+2NiO(OH)
2Ni(OH)2,根据此反应式判断,此电池放电时,正极上发生反应的物质是( )
| 放电 |
| 充电 |
| A、NiO(OH) |
| B、Ni(OH)2 |
| C、H2 |
| D、H2和NiO(OH) |
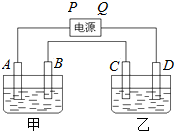 已知A、B、C、D都是铂电极,P、Q是直流电源的两极,通电后发现B极质量增加.
已知A、B、C、D都是铂电极,P、Q是直流电源的两极,通电后发现B极质量增加.