题目内容
25℃时,某一元酸HA的电离常数Ka=10-6,现将0.1mol?L-1的HA溶液和0.1mol?L-1的NaA溶液等体积混合,溶液显 (填“酸性”、“中性”、碱性“).
考点:弱电解质在水溶液中的电离平衡,盐类水解的应用
专题:盐类的水解专题
分析:25℃时,某一元酸HA的电离常数Ka=10-6,NaA中水解平衡常数Kb=
=
=10-8<10-6,说明HA的电离程度大于水解程度,据此判断0.1mol?L-1的HA溶液和0.1mol?L-1的NaA溶液等体积混合后溶液酸碱性.
| Kw |
| Ka |
| 10-14 |
| 10-6 |
解答:
解:25℃时,某一元酸HA的电离常数Ka=10-6,NaA中水解平衡常数Kb=
=
=10-8<10-6,说明HA的电离程度大于水解程度,所以0.1mol?L-1的HA溶液和0.1mol?L-1的NaA溶液等体积混合后溶液呈酸性,故答案为:酸性.
| Kw |
| Ka |
| 10-14 |
| 10-6 |
点评:本题考查了弱电解质的电离和盐类水解,明确Ka、Kb、Kw之间的关系是解本题关键,再结合电离平衡常数与水解平衡常数相对大小判断溶液酸碱性,题目难度不大.

练习册系列答案
 金钥匙试卷系列答案
金钥匙试卷系列答案
相关题目
关于反应2Na2O2+2CO2=2Na2CO3+O2↑ 的说法正确的是( )
| A、该反应的还原剂是CO2 |
| B、该反应的氧化剂是Na2O2,发生氧化反应 |
| C、氧化剂和还原剂的物质的质量比为39:22 |
| D、若有2 mol Na2O2参加反应,则转移电子2 mol |
镍氢电池的总反应为 H2+2NiO(OH)
2Ni(OH)2,根据此反应式判断,此电池放电时,正极上发生反应的物质是( )
| 放电 |
| 充电 |
| A、NiO(OH) |
| B、Ni(OH)2 |
| C、H2 |
| D、H2和NiO(OH) |
下列说法正确的是( )
| A、农业废弃物、城市与工业有机废弃物及动物粪便中都蕴藏着丰富的生物质能 |
| B、羊毛、过氧化氢酶、牛胰岛素、血红蛋白、人造奶油充分水解均可得到氨基酸 |
| C、石墨烯是一种从石墨材料中用“撕裂”方法剥离出的单层碳原子面材料,用这种方法从C60、金刚石等中获得“只有一层碳原子厚的碳薄片”也必将成为研究方向 |
| D、多植树造林,使用“乙醇汽油”,改燃煤为燃气,外出时使用PM2.5口罩等都是治理“雾霾”等灾害性天气的有效措施 |
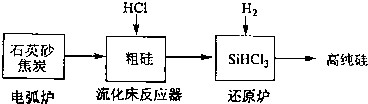
 一定条件下,在2L的密闭容器中,发生下述反应:N2(g)+3H2(g)?2NH3(g)△H=-92.4KJ/mol
一定条件下,在2L的密闭容器中,发生下述反应:N2(g)+3H2(g)?2NH3(g)△H=-92.4KJ/mol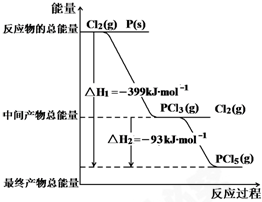 红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示( 图中的△H表示生成1mol产物的数据).根据图示,回答下列问题:
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示( 图中的△H表示生成1mol产物的数据).根据图示,回答下列问题: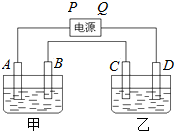 已知A、B、C、D都是铂电极,P、Q是直流电源的两极,通电后发现B极质量增加.
已知A、B、C、D都是铂电极,P、Q是直流电源的两极,通电后发现B极质量增加.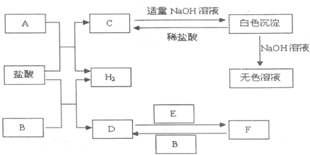 下列物质A~F是我们熟悉的单质或化合物,其中A、E均为C中元素形成的单质,B是常见的金属,且B的合金用量最大;在适当的条件下,它们之间可以发生如图所示的转化.
下列物质A~F是我们熟悉的单质或化合物,其中A、E均为C中元素形成的单质,B是常见的金属,且B的合金用量最大;在适当的条件下,它们之间可以发生如图所示的转化.