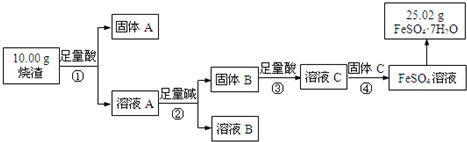
题目内容
1.Wellman-Galusha气化炉是用焦炭为原料生产一氧化碳的装置,它既可用来气化无烟煤,又可用来气化焦炭和烟煤.该气化炉内有下列反应发生:①2C(s)+O2(g)═2CO(g)△H1=-225.8kJ/mol
②C(s)+O2(g)═CO2 (g)△H2=-394.4kJ/mol
请回答:
(1)反应①属于放热(填“吸热”或“放热”)反应.
(2)反应①消耗24gC(s)时,△H=-225.8kJ/mol.
(3)反应②生成1mol CO2(g)时,△H=-394.4kJ/mol.
(4)反应C(s)+CO2(g)═2CO(g)△H=+168.6kJ/mol.
分析 (1)△H1=-225.8kJ/mol<0,所以是放热反应;
(2)由2C(s)+O2(g)═2CO(g)△H1=-225.8kJ/mol可知,消耗2mol的碳放出热量为225.8kJ;
(3)由C(s)+O2(g)═CO2 (g)△H2=-394.4kJ/mol可知,生成1mol的二氧化碳放出热量为:394.4kJ;
(4)①2C(s)+O2(g)═2CO(g)△H1=-225.8kJ/mol
②C(s)+O2(g)═CO2 (g)△H2=-394.4kJ/mol
根据盖斯定律:由①-②得C(s)+CO2(g)═2CO(g)△H的值.
解答 解:(1)△H1=-225.8kJ/mol<0,所以是放热反应,故答案为:放热;
(2)由2C(s)+O2(g)═2CO(g)△H1=-225.8kJ/mol可知,消耗2mol的碳放出热量为225.8kJ,所以消耗24gC(s)时放出热量为225.8kJ,故答案为:-225.8;
(3)由C(s)+O2(g)═CO2 (g)△H2=-394.4kJ/mol可知,生成1mol的二氧化碳放出热量为:394.4kJ,故答案为:-394.4;
(4)①2C(s)+O2(g)═2CO(g)△H1=-225.8kJ/mol
②C(s)+O2(g)═CO2 (g)△H2=-394.4kJ/mol
根据盖斯定律:由①-②得C(s)+CO2(g)═2CO(g)△H=(-225.8kJ/mol)-(-394.4kJ/mol)=+168.6kJ/mol,故答案为:+168.6.
点评 本题考查反应热的计算,题目难度不大,注意盖斯定律的运用.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
11.一定温度下可逆反应:A(s)+2B(g)?2C(g)+D(g);△H>0.现将1molA和2molB加入甲容器中,将4molC和2mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动).下列说法正确的是( )
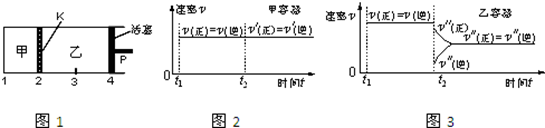

| A. | 保持温度和活塞位置不变,在甲中再加入1 mol A和2 mol B,达到新的平衡后,甲中C的浓度是乙中 C的浓度的2倍 | |
| B. | 保持活塞位置不变,升高温度,达到新的平衡后,甲、乙中B的体积分数均增加 | |
| C. | 保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍 | |
| D. | 保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略) |
12.短周期元素甲和乙,甲原子的最外层电子数为a,次外层电子数为b;乙原子的M层电子数为(a-b),L层电子数为(a+b).则甲、乙两元素形成的化合物具有的性质是( )
| A. | 与水反应 | B. | 与氢氧化钠溶液反应 | ||
| C. | 与硫酸反应 | D. | 与前三种物质均能反应 |
9.下列反应的离子方程式正确的是( )
| A. | 铁与硫酸铜溶液反应:Fe+Cu2+═Cu+Fe 3+ | |
| B. | 铜与稀硝酸反应:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O | |
| C. | 铝与氢氧化钠溶液反应:2Al+2OH-+2H2O═2AlO2-+3H2↑ | |
| D. | 氢氧化钡溶液与稀硫酸反应:Ba2++SO42-+H++OH-═BaSO4↓+H2O |
6.针对下面10种元素,完成以下各小题.回答下列间题.
(1)非金属性最强的元素是氟(填名称).化学性质最不活泼的元素是Ne(填元素符号).
(2)S 原子结构示意图为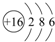 ;
;
(3)Mg和Al中,原子半径较小的是Al;
(4)N的氢化物的分子式NH3,该物质中N元素与H元素的质量比为14:3,(相对原子质量:N-14 H-1),其水溶液呈碱性性.
(5)元素硅的氧化物常用于制造光导纤维(填一种高性能的现代通讯材料的名称);
(6)元素最高价氧化物对应的水化物中,碱性最强的是NaOH(填化学式),呈两性的是Al(OH)3(填化学式);两者反应的化学方程式NaOH+Al(OH)3=NaAlO2+2H2O.
 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | 0 |
| 2 | C | N | F | Ne | ||||
| 3 | Na | Mg | Al | Si | S | Cl |
(2)S 原子结构示意图为
 ;
;(3)Mg和Al中,原子半径较小的是Al;
(4)N的氢化物的分子式NH3,该物质中N元素与H元素的质量比为14:3,(相对原子质量:N-14 H-1),其水溶液呈碱性性.
(5)元素硅的氧化物常用于制造光导纤维(填一种高性能的现代通讯材料的名称);
(6)元素最高价氧化物对应的水化物中,碱性最强的是NaOH(填化学式),呈两性的是Al(OH)3(填化学式);两者反应的化学方程式NaOH+Al(OH)3=NaAlO2+2H2O.
13.2015年初,全国范围内遭遇了严重的雾霾天气,为了改善空气质量,政府提出减少化石能源的使用,提倡新能源,国家大力扶持光电产业,下列说法错误的是( )
| A. | 光伏发电主要利用高纯度单质硅制成的硅太阳能电池 | |
| B. | 硅太阳能电池可将太阳能直接转化为电能,减少化石燃料的使用,保护环境 | |
| C. | 硅的结构和金刚石类似,是具有金属光泽的灰黑色固体 | |
| D. | 硅单质即能与氢氧化钠反应又能与氢氟酸反应,所以硅是两性 |
10.PbO2在酸性溶液中能将Mn2+氧化成MnO4-,本身被还原为Pb2+.取一支试管,加入适量PbO2固体和适量的稀H2SO4后滴入2mL 1mol/L MnSO4溶液.下列说法错误的是( )
| A. | 上述实验中不能用盐酸代替硫酸 | |
| B. | 将试管充分振荡后静置,溶液颜色变为紫色 | |
| C. | 在酸性条件下,PbO2的氧化性比MnO4-的氧化性强 | |
| D. | 若硫酸锰充分反应,消耗PbO2的物质的量为0.01mol |
11.元素周期表中氧元素的数据见如图,说法正确的是( )
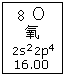

| A. | 氧元素的质量数是16 | |
| B. | 氧元素的相对原子质量是16.00 | |
| C. | 氧原子2p亚层有一个未成对电子 | |
| D. | 氧原子最外层有6个能量相同的电子 |