题目内容
13.2015年初,全国范围内遭遇了严重的雾霾天气,为了改善空气质量,政府提出减少化石能源的使用,提倡新能源,国家大力扶持光电产业,下列说法错误的是( )| A. | 光伏发电主要利用高纯度单质硅制成的硅太阳能电池 | |
| B. | 硅太阳能电池可将太阳能直接转化为电能,减少化石燃料的使用,保护环境 | |
| C. | 硅的结构和金刚石类似,是具有金属光泽的灰黑色固体 | |
| D. | 硅单质即能与氢氧化钠反应又能与氢氟酸反应,所以硅是两性 |
分析 A.硅为良好的半导体材料;
B.太阳能为清洁能源;
C.根据晶体硅的物理性质判断;
D.两性物质是指与酸、碱反应都只生成盐和水.
解答 解:A.硅为良好的半导体材料,可以用于制造太阳能电池,故A正确;
B.太阳能为清洁能源,太阳能的使用减少化石燃料的使用,保护环境,故B正确;
C.晶体硅是一种有金属光泽的灰黑色的固体,熔点高,硬度大,有脆性,故C正确;
D.硅与氢氟酸反应生成四氟化硅和水,不符合两性物质概念,不是两性物质,故D错误;
故选:D.
点评 本题考查了硅的性质及用途,掌握硅的性质是解题关键,注意两性物质的概念,题目难度不大.

练习册系列答案
相关题目
4.某粒子的结构示意图为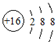 ,关于该粒子的说法正确的是( )
,关于该粒子的说法正确的是( )
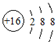 ,关于该粒子的说法正确的是( )
,关于该粒子的说法正确的是( )| A. | 核电荷数为18 | B. | 核外有3个电子层 | ||
| C. | 属于非金属元素的原子 | D. | 在化学反应中易得2个电子 |
18.下列叙述正确的是( )
(1)二氧化硫使品红溶液,溴水和酸性高锰酸钾溶液褪色是因为二氧化硫具有漂白性.
(2)二氧化硫溶于水得到的溶液有氧化性,还原性,酸性.
(3)二氧化硫通入氢氧化钡溶液中,有白色沉淀生成,加入盐酸沉淀溶解.
(4)二氧化硫通入氯化钡溶液中有沉淀生成.
(1)二氧化硫使品红溶液,溴水和酸性高锰酸钾溶液褪色是因为二氧化硫具有漂白性.
(2)二氧化硫溶于水得到的溶液有氧化性,还原性,酸性.
(3)二氧化硫通入氢氧化钡溶液中,有白色沉淀生成,加入盐酸沉淀溶解.
(4)二氧化硫通入氯化钡溶液中有沉淀生成.
| A. | (1)(4) | B. | (4)(3) | C. | (1)(2) | D. | (2)(3) |
5.下列有关物质结构的叙述正确的是( )
| A. | 在离子化合物中不可能存在非极性共价键 | |
| B. | 由电子定向移动而导电的物质一定是金属晶体 | |
| C. | 有键能很大的共价键存在的物质熔沸点一定很高 | |
| D. | 只含有共价键的物质不一定是共价化合物 |
2.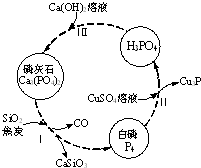 磷及部分重要化合物的相互转化如图所示.
磷及部分重要化合物的相互转化如图所示.
(1)不慎将白磷沾到皮肤上,可用0.2mol/L CuSO4溶液冲洗,根据步骤Ⅱ可判断,1mol CuSO4所能氧化的白磷的物质的量为0.05mol.
(2)步骤Ⅲ中,反应物的比例不同可获得不同的产物,除Ca3(PO4)2外可能的产物还有Ca (H2PO4)2、CaHPO4.
磷灰石是生产磷肥的原料,它的组成可以看作是Ca3(PO4)2、CaF2、CaSO4、CaCO3、SiO2的混合物,部分元素的分析结果如下(各元素均以氧化物形式表示):
(3)磷灰石中,碳元素的质量分数为1.66%%(保留两位小数).
(4)取100g磷灰石粉末,加入足量的浓硫酸,并加热,钙元素全部以CaSO4的形式存在,可以得到CaSO4114.87g(保留两位小数).
(5)取m g 磷灰石粉末,用50.00mL混酸溶液(磷酸为0.5mol/L、硫酸为0.1mol/L)与其反应,结果Ca、S、P元素全部以CaSO4和Ca(H2PO4)2的形式存在,求m的值.
 磷及部分重要化合物的相互转化如图所示.
磷及部分重要化合物的相互转化如图所示.(1)不慎将白磷沾到皮肤上,可用0.2mol/L CuSO4溶液冲洗,根据步骤Ⅱ可判断,1mol CuSO4所能氧化的白磷的物质的量为0.05mol.
(2)步骤Ⅲ中,反应物的比例不同可获得不同的产物,除Ca3(PO4)2外可能的产物还有Ca (H2PO4)2、CaHPO4.
磷灰石是生产磷肥的原料,它的组成可以看作是Ca3(PO4)2、CaF2、CaSO4、CaCO3、SiO2的混合物,部分元素的分析结果如下(各元素均以氧化物形式表示):
| 成分 | CaO | P2O5 | SO3 | CO2 |
| 质量分数(%) | 47.30 | 28.40 | 3.50 | 6.10 |
(4)取100g磷灰石粉末,加入足量的浓硫酸,并加热,钙元素全部以CaSO4的形式存在,可以得到CaSO4114.87g(保留两位小数).
(5)取m g 磷灰石粉末,用50.00mL混酸溶液(磷酸为0.5mol/L、硫酸为0.1mol/L)与其反应,结果Ca、S、P元素全部以CaSO4和Ca(H2PO4)2的形式存在,求m的值.
3.已知N2(g)+3H2(g)?2NH3(g)+Q1反应历程的能量变化如曲线I,说法正确的是( )
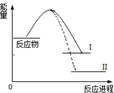

| A. | 1molN≡N键能与3molH-H键能之和大于6molN-H键能,所以反应为放热 | |
| B. | N2(g)+3H2(g)?2NH3(l)+Q2反应历程的能量变化如曲线Ⅱ,则Q2>Q1 | |
| C. | 选择合适的催化剂,可以降低反应所需温度,Q1值也相应减少 | |
| D. | 2mol氨气的能量高于1mol氮气和3mol氢气的能量之和,所以反应需要高温 |
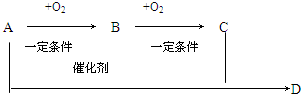 根据如图有机物的转化关系回答.已知A是乙醇.
根据如图有机物的转化关系回答.已知A是乙醇.