题目内容
9.下列反应的离子方程式正确的是( )| A. | 铁与硫酸铜溶液反应:Fe+Cu2+═Cu+Fe 3+ | |
| B. | 铜与稀硝酸反应:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O | |
| C. | 铝与氢氧化钠溶液反应:2Al+2OH-+2H2O═2AlO2-+3H2↑ | |
| D. | 氢氧化钡溶液与稀硫酸反应:Ba2++SO42-+H++OH-═BaSO4↓+H2O |
分析 A.铁与硫酸铜反应生成硫酸亚铁和铜离子,不会生成铁离子;
B.铜与稀硝酸反应生成的是NO气体;
C.铝与氢氧化钠溶液反应生成偏铝酸钠和氢气;
D.氢氧化钡溶液与稀硫酸反应生成硫酸钡沉淀和水,氢离子和氢氧根离子的系数错误.
解答 解:A.铁与硫酸铜溶液反应生成硫酸亚铁和铜离子,正确的离子方程式为:Fe+Cu2+═Cu+Fe2+,故A错误;
B.铜与稀硝酸反应生成硝酸铜、一氧化氮气体和水,正确的离子方程式为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,故B错误;
C.铝与氢氧化钠溶液反应的离子方程式为:2Al+2OH-+2H2O═2AlO2-+3H2↑,故C正确;
D.氢氧化钡溶液与稀硫酸反应生成硫酸钡和水,正确的离子方程式为:Ba2++SO42-+2H++2OH-═BaSO4↓+2H2O,故D错误;
故选C,
点评 本题考查了离子方程式的书写判断,为高考的高频题,属于中等难度的试题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法,如:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
19.25℃时,电离平衡常数:
回答下列问题:
(1)物质的量浓度为0.1mol•L-1的下列 4 种物质,pH 最大的是A.
A.NaCO3 B.NaCLO C.CH3COONa D.NaHCO3
(2)若增大氯水中次氯酸的浓度,不宜向氯水中加入的物质是A.
A.Na2CO3 B.NaCLO C.CH3COONa D.NaHCO3
(3)常温下0.1mol•L-1的CH3COOH 溶液加水稀释过程,下列表达式的数据一定变小的是
A.
A.c(H+) B.$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$ C.c(H+)c(OH-) D.$\frac{c(O{H}^{-})}{c({H}^{+})}$
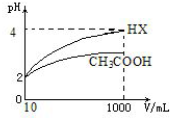
(4)体积为10mLpH=2 的醋酸溶液与一元酸HX 分别加水稀释至1000mL,稀释过程pH 变
化如下图所示,则HX 的酸性大于(填“大于”“等于”或“小于”)醋酸的酸性;稀释后,
HX 溶液中水电离出来的c(H+)大于醋酸溶液水电离出来c(H+)(填“大于”“等于”或“小于”).
(5)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中
?c(CH3COO-)-c(Na+)=1.0×10-6-1.0×10-8mol/L.(填准确数值)
| 弱酸化学式 | CH3COOH | HCLO | H2CO3 |
| 电离平衡常数(25℃) | 1.75×10-5 | 3.0×10-8 | K1=4.4×10-7 K2=4.7×10-11 |
(1)物质的量浓度为0.1mol•L-1的下列 4 种物质,pH 最大的是A.
A.NaCO3 B.NaCLO C.CH3COONa D.NaHCO3
(2)若增大氯水中次氯酸的浓度,不宜向氯水中加入的物质是A.
A.Na2CO3 B.NaCLO C.CH3COONa D.NaHCO3
(3)常温下0.1mol•L-1的CH3COOH 溶液加水稀释过程,下列表达式的数据一定变小的是
A.
A.c(H+) B.$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$ C.c(H+)c(OH-) D.$\frac{c(O{H}^{-})}{c({H}^{+})}$
(4)体积为10mLpH=2 的醋酸溶液与一元酸HX 分别加水稀释至1000mL,稀释过程pH 变
化如下图所示,则HX 的酸性大于(填“大于”“等于”或“小于”)醋酸的酸性;稀释后,
HX 溶液中水电离出来的c(H+)大于醋酸溶液水电离出来c(H+)(填“大于”“等于”或“小于”).

(5)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中
?c(CH3COO-)-c(Na+)=1.0×10-6-1.0×10-8mol/L.(填准确数值)
17.在有机化工中,氯气是合成塑料、橡胶、农药和染料等的重要原料.下列关于氯气性质的描述不正确的是( )
| A. | 无气味 | B. | 能溶于水 | C. | 能与水反应 | D. | 能与铜反应 |
4.某粒子的结构示意图为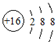 ,关于该粒子的说法正确的是( )
,关于该粒子的说法正确的是( )
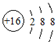 ,关于该粒子的说法正确的是( )
,关于该粒子的说法正确的是( )| A. | 核电荷数为18 | B. | 核外有3个电子层 | ||
| C. | 属于非金属元素的原子 | D. | 在化学反应中易得2个电子 |
18.下列叙述正确的是( )
(1)二氧化硫使品红溶液,溴水和酸性高锰酸钾溶液褪色是因为二氧化硫具有漂白性.
(2)二氧化硫溶于水得到的溶液有氧化性,还原性,酸性.
(3)二氧化硫通入氢氧化钡溶液中,有白色沉淀生成,加入盐酸沉淀溶解.
(4)二氧化硫通入氯化钡溶液中有沉淀生成.
(1)二氧化硫使品红溶液,溴水和酸性高锰酸钾溶液褪色是因为二氧化硫具有漂白性.
(2)二氧化硫溶于水得到的溶液有氧化性,还原性,酸性.
(3)二氧化硫通入氢氧化钡溶液中,有白色沉淀生成,加入盐酸沉淀溶解.
(4)二氧化硫通入氯化钡溶液中有沉淀生成.
| A. | (1)(4) | B. | (4)(3) | C. | (1)(2) | D. | (2)(3) |
19.NaHS溶液中加入一定量的CuSO4溶液,发生的反应的离子方程式可能为( )
| A. | S2-+Cu2+→CuS↓ | B. | 2HS-+Cu2+→CuS↓+2H++S2- | ||
| C. | HS-+Cu2+→CuS↓+H+ | D. | 2HS-+Cu2+→CuS↓+H2S↑ |
