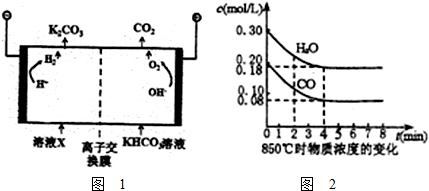
��Ŀ����
����Ԫ��A��B��M��ɵ��������ʷ�����Ӧ����+��=��+�������м���A��M��ɣ�����B��M��ɣ�����ֻ����M��
��1������Ϊ����ɫ���壬�Һͱ���Ϊ�����µ���ɫ��ζ���壮��ĵ���ʽΪ ��������ˮʱ������Ӧ���ӷ���ʽΪ ��
��2������Ϊ��ʹƷ����ɫ����ɫ���壬��Ϊ������ɫ������������ס�����ԭ�Ӹ����Ⱦ�Ϊ1��2��M����+1�ۣ���ԭ������B����A��
��д�����ɱ��Ļ�ѧ����ʽ ��
����MCl2��Һ��ͨ�����嶡�а�ɫ������MCl���������÷�Ӧ�����ӷ���ʽΪ ��
��1������Ϊ����ɫ���壬�Һͱ���Ϊ�����µ���ɫ��ζ���壮��ĵ���ʽΪ
��2������Ϊ��ʹƷ����ɫ����ɫ���壬��Ϊ������ɫ������������ס�����ԭ�Ӹ����Ⱦ�Ϊ1��2��M����+1�ۣ���ԭ������B����A��
��д�����ɱ��Ļ�ѧ����ʽ
����MCl2��Һ��ͨ�����嶡�а�ɫ������MCl���������÷�Ӧ�����ӷ���ʽΪ
���㣺������ƶ�
ר�⣺�ƶ���
����������Ԫ��A��B��M��ɵ��������ʷ�����Ӧ����+��=��+�������м���A��M��ɣ�����B��M��ɣ�����ֻ����M��
��1������Ϊ����ɫ���壬�Һͱ���Ϊ�����µ���ɫ��ζ���壬���ΪNa2O2����ΪCO2����ΪO2����ΪNa2CO3��
��2����Ϊ��ʹƷ����ɫ����ɫ���壬��Ϊ�����Ϻ�ɫ��������ΪSO2����ΪCu��������ס�����ԭ�Ӹ����Ⱦ�Ϊ1��2��M����+1�ۣ���ԭ������B����A�����ΪCu2O����ΪCu2S���Դ������
��1������Ϊ����ɫ���壬�Һͱ���Ϊ�����µ���ɫ��ζ���壬���ΪNa2O2����ΪCO2����ΪO2����ΪNa2CO3��
��2����Ϊ��ʹƷ����ɫ����ɫ���壬��Ϊ�����Ϻ�ɫ��������ΪSO2����ΪCu��������ס�����ԭ�Ӹ����Ⱦ�Ϊ1��2��M����+1�ۣ���ԭ������B����A�����ΪCu2O����ΪCu2S���Դ������
���
�⣺����Ԫ��A��B��M��ɵ��������ʷ�����Ӧ����+��=��+�������м���A��M��ɣ�����B��M��ɣ�����ֻ����M��
��1������Ϊ����ɫ���壬�Һͱ���Ϊ�����µ���ɫ��ζ���壬���ΪNa2O2�������ʽΪ ����ΪCO2����ΪO2����ΪNa2CO3��������ˮ����Һ��̼�������ˮ���Լ��ԣ�������Ӧ���ӷ���ʽΪCO32-+H2O
����ΪCO2����ΪO2����ΪNa2CO3��������ˮ����Һ��̼�������ˮ���Լ��ԣ�������Ӧ���ӷ���ʽΪCO32-+H2O HCO3-+OH-��
HCO3-+OH-��
�ʴ�Ϊ�� ��CO32-+H2O
��CO32-+H2O HCO3-+OH-��
HCO3-+OH-��
��2����Ϊ��ʹƷ����ɫ����ɫ���壬��Ϊ�����Ϻ�ɫ��������ΪSO2����ΪCu��������ס�����ԭ�Ӹ����Ⱦ�Ϊ1��2��M����+1�ۣ���ԭ������B����A�����ΪCu2O����ΪCu2S��
�����ɱ��Ļ�ѧ����ʽΪ2Cu2O+Cu2S=SO2+6Cu��
�ʴ�Ϊ��2Cu2O+Cu2S=SO2+6Cu��
����MCl2����Һ��ͨ�붡���ɹ۲쵽��ɫ��MC1���������ӷ�ӦΪ2Cu2++SO2+2Cl-+2H2O=2CuCl��+SO42-+4H+��
�ʴ�Ϊ��2Cu2++SO2+2Cl-+2H2O=2CuCl��+SO42-+4H+��
��1������Ϊ����ɫ���壬�Һͱ���Ϊ�����µ���ɫ��ζ���壬���ΪNa2O2�������ʽΪ
 ����ΪCO2����ΪO2����ΪNa2CO3��������ˮ����Һ��̼�������ˮ���Լ��ԣ�������Ӧ���ӷ���ʽΪCO32-+H2O
����ΪCO2����ΪO2����ΪNa2CO3��������ˮ����Һ��̼�������ˮ���Լ��ԣ�������Ӧ���ӷ���ʽΪCO32-+H2O HCO3-+OH-��
HCO3-+OH-���ʴ�Ϊ��
 ��CO32-+H2O
��CO32-+H2O HCO3-+OH-��
HCO3-+OH-����2����Ϊ��ʹƷ����ɫ����ɫ���壬��Ϊ�����Ϻ�ɫ��������ΪSO2����ΪCu��������ס�����ԭ�Ӹ����Ⱦ�Ϊ1��2��M����+1�ۣ���ԭ������B����A�����ΪCu2O����ΪCu2S��
�����ɱ��Ļ�ѧ����ʽΪ2Cu2O+Cu2S=SO2+6Cu��
�ʴ�Ϊ��2Cu2O+Cu2S=SO2+6Cu��
����MCl2����Һ��ͨ�붡���ɹ۲쵽��ɫ��MC1���������ӷ�ӦΪ2Cu2++SO2+2Cl-+2H2O=2CuCl��+SO42-+4H+��
�ʴ�Ϊ��2Cu2++SO2+2Cl-+2H2O=2CuCl��+SO42-+4H+��
���������⿼��������ƶϣ�Ϊ��Ƶ���㣬�������ʵ����ʼ������ķ�ӦΪ���Ĺؼ������ط������ƶ������Ŀ��飬ע�����ʵ���ɫ��������ԭ��Ӧ���ɣ���Ŀ�ѶȲ���

��ϰ��ϵ�д�
 ���100��1�ž�ϵ�д�
���100��1�ž�ϵ�д� ��ĩ�óɼ�ϵ�д�
��ĩ�óɼ�ϵ�д�
�����Ŀ

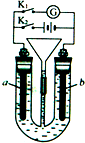 ����ͼ��ʾװ���У�U�ι���װ��ϡH2SO4��aΪ���缫��bΪ���ʯī�缫��
����ͼ��ʾװ���У�U�ι���װ��ϡH2SO4��aΪ���缫��bΪ���ʯī�缫��
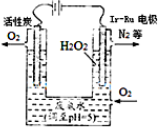 �������������������õ�ⷨ��H2O2���ò�����H2O2�����ϰ�ˮ��װ����ͼ
�������������������õ�ⷨ��H2O2���ò�����H2O2�����ϰ�ˮ��װ����ͼ ��֪ˮ��25���100��ʱ�������ƽ��������ͼ��ʾ��
��֪ˮ��25���100��ʱ�������ƽ��������ͼ��ʾ��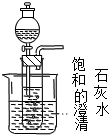 CO2��SO2��NOx�ǶԻ���Ӱ��ϴ�����壬���ƺ�����CO2��SO2��NOx�ǽ������ЧӦ����������⻯ѧ��������Ч;����
CO2��SO2��NOx�ǶԻ���Ӱ��ϴ�����壬���ƺ�����CO2��SO2��NOx�ǽ������ЧӦ����������⻯ѧ��������Ч;����