题目内容
某化学小组欲以CO2为主要原料,采用下图所示装置模拟“侯氏制碱法”制取NaHCO3,并对CO2与NaOH的反应进行探究.
【资料获悉】“侯氏制碱法”原理:NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl,然后再将NaHCO3制成Na2CO3.
【实验设计】如图1所示
【实验探究】
(1)装置乙的作用是 .
(2)由装置丙中产生的NaHCO3制取Na2CO3时,NaHCO3转化为Na2CO3的化学方程式为 .
(3)若在(2)中灼烧时间较短,NaHCO3将分解不完全.取经短暂加热的NaHCO3样品29.6g完全溶于水制成溶液,然后向此溶液中缓慢地滴加稀盐酸,并不断搅拌.随着盐酸的加入,溶液中有关离子的物质的量的变化如图2所示.则曲线b对应的溶液中的离子是 (填离子符号);该样品中Na2CO3和NaHCO3的物质的量之比是 .
(4)若将装置甲产生的纯净的CO2 1.12L(标准状况下)缓慢地全部通入到100mL NaOH溶液中,充分反应后,将溶液低温蒸干,得到不含结晶水的固体W,其质量为4.86g,则W的成分为 (填化学式),原NaOH溶液的物质的量浓度为 .

【资料获悉】“侯氏制碱法”原理:NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl,然后再将NaHCO3制成Na2CO3.
【实验设计】如图1所示
【实验探究】
(1)装置乙的作用是
(2)由装置丙中产生的NaHCO3制取Na2CO3时,NaHCO3转化为Na2CO3的化学方程式为
(3)若在(2)中灼烧时间较短,NaHCO3将分解不完全.取经短暂加热的NaHCO3样品29.6g完全溶于水制成溶液,然后向此溶液中缓慢地滴加稀盐酸,并不断搅拌.随着盐酸的加入,溶液中有关离子的物质的量的变化如图2所示.则曲线b对应的溶液中的离子是
(4)若将装置甲产生的纯净的CO2 1.12L(标准状况下)缓慢地全部通入到100mL NaOH溶液中,充分反应后,将溶液低温蒸干,得到不含结晶水的固体W,其质量为4.86g,则W的成分为

考点:纯碱工业(侯氏制碱法)
专题:元素及其化合物
分析:(1)装置甲是制备二氧化碳,气体中含有氯化氢气体对后续实验产生干扰,需要除去;
(2)NaHCO3转化为Na2CO3的方法是固体加热分解;
(3)混合物是碳酸钠和碳酸氢钠,滴入盐酸发生反应CO32-+H+=HCO3-; HCO3-+H+=CO2↑+H2O;依据图象分析碳酸根离子减小,碳酸氢根离子增多;
(4)根据CO2与NaOH的反应所得产物的可能性来讨论.
(2)NaHCO3转化为Na2CO3的方法是固体加热分解;
(3)混合物是碳酸钠和碳酸氢钠,滴入盐酸发生反应CO32-+H+=HCO3-; HCO3-+H+=CO2↑+H2O;依据图象分析碳酸根离子减小,碳酸氢根离子增多;
(4)根据CO2与NaOH的反应所得产物的可能性来讨论.
解答:
解:(1)装置甲是制备二氧化碳气体的反应装置,生成的二氧化碳气体中含有氯化氢气体,对制备碳酸氢钠有影响,装置乙的作用是吸收氯化氢气体,
故答案为:除去CO2中的HCl;
(2)碳酸氢钠受热分解生成二氧化碳、碳酸钠、水,反应为:2NaHCO3
Na2CO3+H2O+CO2↑,
故答案为:2NaHCO3
Na2CO3+H2O+CO2↑;
(3)若在(2)中灼烧的时间较短,NaHCO3将分解不完全,该小组对一份加热了t1min的NaHCO3样品的组成进行了研究.取加热了t1min的NaHCO3样品29.6g 完全溶于水制成溶液,然后向此溶液中缓慢地滴加稀盐酸,并不断搅拌.随着盐酸的加入,发生反应 CO32-+H+=HCO3-; HCO3-+H+=CO2↑+H2O;溶液中有关离子的物质的量的变化为碳酸根离子减小,碳酸氢根离子浓度增大,当碳酸根离子全部转化为碳酸氢根离子,再滴入盐酸和碳酸氢根离子反应生成二氧化碳,碳酸氢根离子减小,所以b曲线表示的是碳酸根离子浓度变化,碳酸根离子浓度0.2mol/L;碳酸氢根离子浓度为0.1mol/L,样品中Na2CO3和NaHCO3物质的量之比是2:1;
故答案为:CO32-;2:1;
(4)CO2与NaOH溶液反应时,根据NaOH是否过量,分情况讨论:
若NaOH过量或恰好完全反应,0.05molCO2与NaOH反应后生成0.05molNa2CO3,只Na2CO3的质量m=nM=0.05mol×106g/mol=5.3g>4.86g,故假设不成立;说明NaOH不能过量,即所得的固体中为Na2CO3或NaHCO3或两者的混合物.
设所得的固体中Na2CO3的物质的量为Xmol,NaHCO3的物质的量为Ymol,
根据碳元素的守恒可有:X+Y=0.05mol①
根据所得固体的质量为4.86g可有:106X+84Y=4.86g②
解得X=0.03mol Y=0.02mol
故所得的固体中既含Na2CO3又含NaHCO3;
根据所得固体中Na2CO3为0.03mol,NaHCO3为0.02mol,根据钠元素的守恒可知,NaOH的物质的量n=0.03mol×2+0.02mol×2=0.08mol,
故NaOH的物质的量浓度C=
=
=0.8mol/L,
故答案为:Na2CO3和NaHCO3; 0.8 mol/L.
故答案为:除去CO2中的HCl;
(2)碳酸氢钠受热分解生成二氧化碳、碳酸钠、水,反应为:2NaHCO3
| ||
故答案为:2NaHCO3
| ||
(3)若在(2)中灼烧的时间较短,NaHCO3将分解不完全,该小组对一份加热了t1min的NaHCO3样品的组成进行了研究.取加热了t1min的NaHCO3样品29.6g 完全溶于水制成溶液,然后向此溶液中缓慢地滴加稀盐酸,并不断搅拌.随着盐酸的加入,发生反应 CO32-+H+=HCO3-; HCO3-+H+=CO2↑+H2O;溶液中有关离子的物质的量的变化为碳酸根离子减小,碳酸氢根离子浓度增大,当碳酸根离子全部转化为碳酸氢根离子,再滴入盐酸和碳酸氢根离子反应生成二氧化碳,碳酸氢根离子减小,所以b曲线表示的是碳酸根离子浓度变化,碳酸根离子浓度0.2mol/L;碳酸氢根离子浓度为0.1mol/L,样品中Na2CO3和NaHCO3物质的量之比是2:1;
故答案为:CO32-;2:1;
(4)CO2与NaOH溶液反应时,根据NaOH是否过量,分情况讨论:
若NaOH过量或恰好完全反应,0.05molCO2与NaOH反应后生成0.05molNa2CO3,只Na2CO3的质量m=nM=0.05mol×106g/mol=5.3g>4.86g,故假设不成立;说明NaOH不能过量,即所得的固体中为Na2CO3或NaHCO3或两者的混合物.
设所得的固体中Na2CO3的物质的量为Xmol,NaHCO3的物质的量为Ymol,
根据碳元素的守恒可有:X+Y=0.05mol①
根据所得固体的质量为4.86g可有:106X+84Y=4.86g②
解得X=0.03mol Y=0.02mol
故所得的固体中既含Na2CO3又含NaHCO3;
根据所得固体中Na2CO3为0.03mol,NaHCO3为0.02mol,根据钠元素的守恒可知,NaOH的物质的量n=0.03mol×2+0.02mol×2=0.08mol,
故NaOH的物质的量浓度C=
| n |
| V |
| 0.08mol |
| 0.1L |
故答案为:Na2CO3和NaHCO3; 0.8 mol/L.
点评:本题考查了 工业制纯碱的原理分析,生产过程中的物质变化,混合物成分的分析判断和计算应用,实验过程分析,除杂操作,尾气吸收,图象定量分析判断,题目难度中等.

练习册系列答案
相关题目
如表为元素周期表短周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )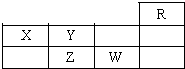

| A、常压下五种元素的单质中W单质的沸点最高 |
| B、Z的氢化物比Y的氢化物稳定 |
| C、W元素最高价氧化物的水化物酸性比Z元素的强 |
| D、Z、W的阴离子电子层结构与R原子的相同 |
化学与生活密切相关,下列有关说法正确的是( )
| A、加热能杀死H1N1流感病毒是因为病毒蛋白质受热变性 |
| B、不锈钢是利用了牺牲阳极的阴极保护法来达到防止腐蚀的目的 |
| C、明矾和漂白粉常用于自来水的净化和杀菌消毒,两者的作用原理相同 |
| D、加碘食盐中主要添加的是碘化钾 |

 ,写出由G生成I的化学反应方程式
,写出由G生成I的化学反应方程式
 将一定质量的Mg和Al的混合物投入500mL稀硫酸中,固体全部溶解并产生气体.待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示.
将一定质量的Mg和Al的混合物投入500mL稀硫酸中,固体全部溶解并产生气体.待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示.