题目内容
8.某学生记录数据如下:| 实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | 氢氧化钠 | 混合溶液 | |
| 1 | 20.0 | 20.1 | 23.2 |
| 2 | 20.2 | 20.4 | 23.4 |
| 3 | 20.5 | 20.6 | 23.6 |
分析 先根据表中测定数据计算出混合液反应前后的平均温度差,再根据Q=cm△T计算出反应放出的热量,最后计算出中和热.
解答 解:第1次实验盐酸和NaOH溶液起始平均温度为:$\frac{20.0+20.1}{2}$℃=20.05℃,反应后温度为:23.2℃,反应前后温差为:3.15℃;
第2次实验盐酸和NaOH溶液起始平均温度为:$\frac{20.2+20.4}{2}$℃=20.3℃,反应后温度为:23.4℃,反应前后温度差为:3.1℃;
第3次实验盐酸和NaOH溶液起始平均温度为:$\frac{20.5+20.6}{2}$℃=20.55℃,反应后温度为:23.6℃,反应前后温度差为:3.05℃;
40mL的0.50mol/L盐酸与40mL的0.55mol/L氢氧化钠溶液的质量和为:m=80mL×1g/cm3=80g,c=4.18J/(g•℃),
生成0.05mol的水放出热量为:Q=cm△T=4.18J/(g•℃)×80g×$\frac{3.15℃+3.1℃+3.05}{3}$=1.036kJ,即生成0.02mol的水放出热量为:1.036kJ,
所以生成1mol的水放出热量为:1.036kJ×$\frac{1mol}{0.02mol}$=-51.8kJ/mol,
所以该实验测得的中和热△H=-51.8kJ/mol,
故答案为:-51.8kJ/mol.
点评 本题考查热化学方程式以及反应热的计算,题目难度大,注意理解中和热测定原理以及测定反应热的误差等问题,试题有利于培养学生灵活应用所学知识的能力.

练习册系列答案
相关题目
20.Fe2+检验的方法正确的是( )
| A. | 滴加氢氧化钠溶液 | B. | 先滴加KSCN溶液,再滴加盐酸 | ||
| C. | 滴加KSCN溶液 | D. | 先滴加氯水,再滴加KSCN溶液 |
19.下列有关Na2CO3和NaHCO3的叙述中,正确的是( )
| A. | 受热时,NaHCO3比Na2CO3容易分解 | |
| B. | NaHCO3俗名苏打,Na2CO3俗名纯碱 | |
| C. | NaHCO3溶液显酸性,Na2CO3溶液显碱性 | |
| D. | NaHCO3和Na2CO3各1mol分别与过量盐酸反应,产生CO2的质量不同 |
16.如图,CPAE是蜂胶的主要活性成分,也可由咖啡酸合成.下列说法不正确的是( )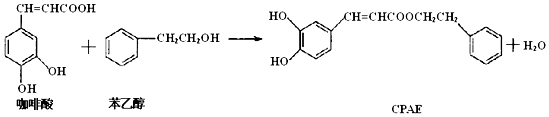

| A. | 咖啡酸分子中所有碳原子可能处在同一个平面上 | |
| B. | 1 mol CPAE与足量的溴水反应,最多消耗3molBr2 | |
| C. | 1 mol 苯乙醇在O2中完全燃烧,需消耗10 mol O2 | |
| D. | 1 mol CPAE与足量的NaOH溶液反应,最多消耗3 mol NaOH |
3. 在一密闭容器中进行以下可逆反应:M(g)+N(g)?P(g)+2L.在不同的条件下P的百分含量P%的变化情况如图,则反应( )
在一密闭容器中进行以下可逆反应:M(g)+N(g)?P(g)+2L.在不同的条件下P的百分含量P%的变化情况如图,则反应( )
 在一密闭容器中进行以下可逆反应:M(g)+N(g)?P(g)+2L.在不同的条件下P的百分含量P%的变化情况如图,则反应( )
在一密闭容器中进行以下可逆反应:M(g)+N(g)?P(g)+2L.在不同的条件下P的百分含量P%的变化情况如图,则反应( )| A. | 正反应放热,L是固体 | B. | 正反应放热,L是气体 | ||
| C. | 正反应吸热,L是气体 | D. | 正反应吸热,L是固体 |
13.下列所得溶液的物质的量浓度等于 0.1mol•L-1 的是( )
| A. | 将 0.1 mol 氨充分溶解在 1 L 水中 | |
| B. | 将 10 g 质量分数为 98%的硫酸与 990 g 水混合 | |
| C. | 将 8 g 三氧化硫溶于水并配成 1 L 溶液 | |
| D. | 将 0.1 mol 氧化钠溶于水并配成 1L 溶液 |
17.将一定量的由Cu和Cu2O组成的混合粉末加入到125mL2.6mol•L-1的硝酸中,固体恰好完全溶解,得蓝色溶液X并收集到VmL(标准状况)的纯净无色气体Y.下列结论正确的是( )
| A. | X中有两种溶质 | |
| B. | Y通入纯水中得到酸性溶液 | |
| C. | 原混合粉末的总质量小于7.8g | |
| D. | 当V=1680时,原混合粉末中Cu和Cu2O的物质的量之比为8:1 |
18.下列分子中含有的电子数目与HF相同,且分子中只有2个σ键的是( )
| A. | H2O | B. | CO2 | C. | N2O | D. | CH4 |