题目内容
20.体积相同、pH均等于l的盐酸和CH3COOH溶液,分别加水稀释m倍、n倍,溶液的pH都变成3,则m与n的关系为m<n.分析 醋酸为弱电解质,加水稀释时,促进醋酸的电离,氢离子物质的量增多,盐酸中氢离子物质的量不变,据此分析.
解答 解:体积相同,pH均等于1的盐酸和CH3COOH溶液,加水稀释时,促进醋酸的电离,氢离子物质的量增多,盐酸中氢离子物质的量不变,分别加水稀释m倍、n倍,溶液的pH都变成3,氢离子浓度相等,醋酸稀释倍数大;
故答案为:m<n.
点评 本题考查了pH的简单计算,题目难度不大,注意弱电解质在水中部分电离的特点以及加水稀释对电离平衡移动的影响.

练习册系列答案
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案
相关题目
12.我国油气资源匮乏而煤储量相对丰富.将煤转化为水煤气(CO、H2),不可能产生的效果是( )
| A. | 得到相对清洁的能源 | B. | 提高了能源利用率 | ||
| C. | 增加了单位质量煤的热值 | D. | 便于管道输送 |
11.KMnO4和MnO2都是重要化学物质,在实验室可以做氧化剂和催化剂,某学习小组对两种物质的制备和性质探究如下:
I.MnO2的制备:
该学习小组设计了将粗MnO2(含有较多的MnO、MnCO3和Fe2O3)样品转化为纯MnO2实验,其工艺流程如图:

请回答下列问题:
(1)第①步操作中,生成CO2的化学方程式为MnCO3+H2SO4=MnSO4+H2O+CO2↑.
(2)第②步操作中,NaClO3氧化MnSO4的离子方程式为2ClO3-+5Mn2++4H2O=5MnO2+Cl2↑+8H+.
(3)第③步操作中,最终得到的固体除NaClO3外,还一定含有下列物质中的ad(填序号).
a.NaCl b.NaClO c.NaClO4 d.NaOH
(4)为得到纯净的MnO2,须将过滤后的MnO2合并后进行洗涤.洗涤沉淀所用的玻璃仪器有:烧杯、漏斗、玻璃棒,判断是否洗涤干净可选用的试剂是BaCl2(填化学式).
(5)NaClO3和MnO2在一定条件下都可以氧化浓盐酸制取氯气,制取等量的氯气消耗NaClO3与MnO2的物质的量之比为1:3.
(6)工业上可以以石墨为电极电解酸化的硫酸锰制取二氧化锰,该过程的阳极反应式为Mn2+-2e-+2H2O=MnO2+4H+.
II.KMnO4的制备和性质:
(7)实验室由二氧化锰制备高锰酸钾可分二步进行:
第一步:MnO2与KOH共熔并通入氧气:2MnO2+4KOH+O2=2K2MnO4+2H2O
第二步:通入CO2,可使K2MnO4发生歧化反应生成KMnO4和MnO2.
第二步完成反应时,转化为KMnO4的K2MnO4占其全部的百分率约为66.7%(精确到0.1%)
(8)该小组同学为了探究KMnO4溶液和Na2C2O4溶液的反应过程,将酸性KMnO4溶液逐滴滴入一定体积的Na2C2O4溶液中(温度相同,并不断振荡),记录的现象如表:
下列说法中错误的是( )
①请将MnO4-氧化C2O42-的离子方程式补充完整:
2MnO4-+C2O42-+16H+=2Mn2++10CO2↑+8H2O
②请分析KMnO4溶液褪色时间变化的可能原因反应生成的Mn2+对反应有催化作用,且c(Mn2+)浓度大催化效果更好.
I.MnO2的制备:
该学习小组设计了将粗MnO2(含有较多的MnO、MnCO3和Fe2O3)样品转化为纯MnO2实验,其工艺流程如图:

请回答下列问题:
(1)第①步操作中,生成CO2的化学方程式为MnCO3+H2SO4=MnSO4+H2O+CO2↑.
(2)第②步操作中,NaClO3氧化MnSO4的离子方程式为2ClO3-+5Mn2++4H2O=5MnO2+Cl2↑+8H+.
(3)第③步操作中,最终得到的固体除NaClO3外,还一定含有下列物质中的ad(填序号).
a.NaCl b.NaClO c.NaClO4 d.NaOH
(4)为得到纯净的MnO2,须将过滤后的MnO2合并后进行洗涤.洗涤沉淀所用的玻璃仪器有:烧杯、漏斗、玻璃棒,判断是否洗涤干净可选用的试剂是BaCl2(填化学式).
(5)NaClO3和MnO2在一定条件下都可以氧化浓盐酸制取氯气,制取等量的氯气消耗NaClO3与MnO2的物质的量之比为1:3.
(6)工业上可以以石墨为电极电解酸化的硫酸锰制取二氧化锰,该过程的阳极反应式为Mn2+-2e-+2H2O=MnO2+4H+.
II.KMnO4的制备和性质:
(7)实验室由二氧化锰制备高锰酸钾可分二步进行:
第一步:MnO2与KOH共熔并通入氧气:2MnO2+4KOH+O2=2K2MnO4+2H2O
第二步:通入CO2,可使K2MnO4发生歧化反应生成KMnO4和MnO2.
第二步完成反应时,转化为KMnO4的K2MnO4占其全部的百分率约为66.7%(精确到0.1%)
(8)该小组同学为了探究KMnO4溶液和Na2C2O4溶液的反应过程,将酸性KMnO4溶液逐滴滴入一定体积的Na2C2O4溶液中(温度相同,并不断振荡),记录的现象如表:
| 起始加入量(mol) | 平衡时 | ||||
| A | B | C | A或C转化率(%) | C的物质的量分数(%) | 放出或吸收热量(KJ) |
| 1 | 1 | 0 | α1 | φ1 | Q1 |
| 0 | 0 | 2 | α2 | φ2 | Q2 |
| 2 | 2 | 0 | α2 | φ3 | Q3 |
①请将MnO4-氧化C2O42-的离子方程式补充完整:
2MnO4-+C2O42-+16H+=2Mn2++10CO2↑+8H2O
②请分析KMnO4溶液褪色时间变化的可能原因反应生成的Mn2+对反应有催化作用,且c(Mn2+)浓度大催化效果更好.
8.某学生记录数据如下:
依据该学生的实验数据计算,该实验测得的中和热△H=-51.8kJ/mol.
| 实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | 氢氧化钠 | 混合溶液 | |
| 1 | 20.0 | 20.1 | 23.2 |
| 2 | 20.2 | 20.4 | 23.4 |
| 3 | 20.5 | 20.6 | 23.6 |
15.下列有关铝的叙述错误的是( )
| A. | 铝制的容器可以贮存浓硫酸或浓硝酸 | |
| B. | 铝容易形成致密的氧化膜,抗腐蚀性能好 | |
| C. | 工业上电解氯化铝溶液可分解得到铝和氯气 | |
| D. | 工业上常用铝热反应进行焊接铁轨 |
5.下列化学用语正确的是( )
| A. | 丙烯的实验式:C3H6 | B. | CO2的电子式: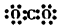 | ||
| C. | 镁离子的结构示意图: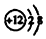 | D. | 中子数为18 的氯原子符号:1718Cl |
12.在H2SO4、K2SO4、Al2(SO4)3和明矾的混合溶液中,H+的浓度为0.2mol/L,SO42-的浓度为0.5mol/L,当加入等体积0.6mol/L KOH溶液时,生成的沉淀恰好完全溶解.则反应后溶液中K+的浓度约为( )
| A. | 0.225mol/L | B. | 0.25mol/L | C. | 0.45mol/L | D. | 0.55mol/L |
9.下列离子方程式书写正确的是( )
| A. | C12与水反应:C12+H2O═2H++Cl-+ClO- | |
| B. | AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ | |
| C. | Fe跟HCl溶液反应:Fe+2H+═Fe2++H2↑ | |
| D. | BaCO3与盐酸反应:CO32-+2 H+═H2O+CO2↑ |
10.活动小组同学采用如图装置制备并测定所得固体中亚硝酸钠(NaNO2)的质量分数(装置可重复使用,部分夹持仪器已省略).

已知:①2NO+Na2O2═2NaNO2;
②酸性条件下,NO、NO2都能与MnO4-反应生成NO3-和Mn2+;NaNO2能使
酸性高锰酸钾溶液褪色.
(1)实验装置的连接顺序为ACEDEB;
(2)C瓶内发生反应的离子方程式为Cu+2H++NO2=Cu2++NO+H2O.
(3)为了测定亚硝酸钠的含量,称取4.0g样品溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.10mol•L-1的酸性KMnO4溶液进行滴定,实验所得数据如表.
①第一组实验数据出现较明显异常,造成异常的原因可能是ac(填字母序号).
a.酸式滴定管用蒸馏水洗净后未用标准液润洗
b.锥形瓶用蒸馏水洗净后未干燥
c.观察滴定终点时仰视读数
②根据表中数据进行计算,所制得的固体中亚硝酸钠的质量分数为86.25%.
(4)设计实验,比较0.1mol•L-1NaNO2溶液中NO2-的水解程度和0.1mol•L-1HNO2溶液中HNO2电离程度的相对大小25℃时,将两种溶液等体积混合,若混合溶液的pH<7,则说明HNO2的电离程度大于NO2-的水解程度;若pH>7,则说明HNO2的电离程度小于NO2-的水解程度(简要说明实验步骤、现象和结论,仪器和药品自选).

已知:①2NO+Na2O2═2NaNO2;
②酸性条件下,NO、NO2都能与MnO4-反应生成NO3-和Mn2+;NaNO2能使
酸性高锰酸钾溶液褪色.
(1)实验装置的连接顺序为ACEDEB;
(2)C瓶内发生反应的离子方程式为Cu+2H++NO2=Cu2++NO+H2O.
(3)为了测定亚硝酸钠的含量,称取4.0g样品溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.10mol•L-1的酸性KMnO4溶液进行滴定,实验所得数据如表.
| 滴定次数 | 1 | 2 | 3 | 4 |
| KMnO4溶液体积/mL | 20.60 | 20.02 | 20.00 | 19.98 |
a.酸式滴定管用蒸馏水洗净后未用标准液润洗
b.锥形瓶用蒸馏水洗净后未干燥
c.观察滴定终点时仰视读数
②根据表中数据进行计算,所制得的固体中亚硝酸钠的质量分数为86.25%.
(4)设计实验,比较0.1mol•L-1NaNO2溶液中NO2-的水解程度和0.1mol•L-1HNO2溶液中HNO2电离程度的相对大小25℃时,将两种溶液等体积混合,若混合溶液的pH<7,则说明HNO2的电离程度大于NO2-的水解程度;若pH>7,则说明HNO2的电离程度小于NO2-的水解程度(简要说明实验步骤、现象和结论,仪器和药品自选).