题目内容
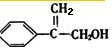
16.如图,CPAE是蜂胶的主要活性成分,也可由咖啡酸合成.下列说法不正确的是( )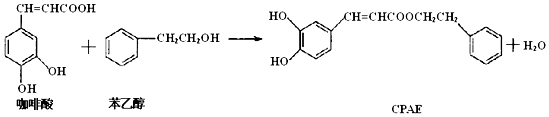
| A. | 咖啡酸分子中所有碳原子可能处在同一个平面上 | |
| B. | 1 mol CPAE与足量的溴水反应,最多消耗3molBr2 | |
| C. | 1 mol 苯乙醇在O2中完全燃烧,需消耗10 mol O2 | |
| D. | 1 mol CPAE与足量的NaOH溶液反应,最多消耗3 mol NaOH |
分析 A.苯环、乙烯中所有原子共平面,根据乙烯和苯的结构判断咖啡酸中碳原子是否共面;
B.CPAE中苯环上酚羟基的邻对位氢原子能和溴发生取代反应,碳碳双键能和溴发生加成反应;
C.1mol苯乙醇完全燃烧耗氧量=1mol×[n(C)+$\frac{n(H)}{4}$-$\frac{n(O)}{2}$];
D.CPAE中能和NaOH反应的有酯基水解生成的羧基、酚羟基.
解答 解:A.苯环、乙烯中所有原子共平面,根据乙烯和苯的结构知,咖啡酸中所有碳原子可能共平面,故A正确;
B.CPAE中苯环上酚羟基的邻对位氢原子能和溴发生取代反应,碳碳双键能和溴发生加成反应,所有1 mol CPAE与足量的溴水反应,最多消耗4molBr2,故B错误;
C.苯乙醇的分子式为C8H10O,1mol苯乙醇完全燃烧耗氧量=1mol×[n(C)+$\frac{n(H)}{4}$-$\frac{n(O)}{2}$]=1mol×[8+$\frac{10}{4}$-$\frac{1}{2}$]=10mol,故C正确;
D.CPAE中能和NaOH反应的有酯基水解生成的羧基、酚羟基,所有1 mol CPAE与足量的NaOH溶液反应,最多消耗3 mol NaOH,故D正确;
故选B.
点评 本题考查有机物结构和性质,明确官能团及其性质关系、物质的量的有关计算等知识点是解本题关键,注意酚中苯环上能和溴发生取代反应的位置,知道烃及其衍生物耗氧量的计算方法,题目难度不大.

练习册系列答案
相关题目
7.在容积不变的密闭容器中发生反应:N2(g)+3H2(g)?2NH3(g),反应达平衡状态的标志是( )
①单位时间内生成n mol N2的同时生成2n mol NH3
②用N2、H2、NH3的物质的量浓度变化表示的反应速率比为1:3:2的状态
③2v(H2)正=3v(NH3)逆
④混合气体的密度不再改变的状态
⑤混合气体的平均相对分子质量不再改变的状态.
①单位时间内生成n mol N2的同时生成2n mol NH3
②用N2、H2、NH3的物质的量浓度变化表示的反应速率比为1:3:2的状态
③2v(H2)正=3v(NH3)逆
④混合气体的密度不再改变的状态
⑤混合气体的平均相对分子质量不再改变的状态.
| A. | ①③④ | B. | ②③⑤ | C. | ①③⑤ | D. | ①②③④⑤ |
11.KMnO4和MnO2都是重要化学物质,在实验室可以做氧化剂和催化剂,某学习小组对两种物质的制备和性质探究如下:
I.MnO2的制备:
该学习小组设计了将粗MnO2(含有较多的MnO、MnCO3和Fe2O3)样品转化为纯MnO2实验,其工艺流程如图:
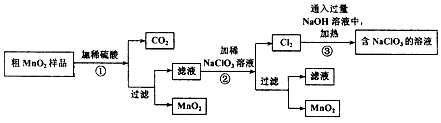
请回答下列问题:
(1)第①步操作中,生成CO2的化学方程式为MnCO3+H2SO4=MnSO4+H2O+CO2↑.
(2)第②步操作中,NaClO3氧化MnSO4的离子方程式为2ClO3-+5Mn2++4H2O=5MnO2+Cl2↑+8H+.
(3)第③步操作中,最终得到的固体除NaClO3外,还一定含有下列物质中的ad(填序号).
a.NaCl b.NaClO c.NaClO4 d.NaOH
(4)为得到纯净的MnO2,须将过滤后的MnO2合并后进行洗涤.洗涤沉淀所用的玻璃仪器有:烧杯、漏斗、玻璃棒,判断是否洗涤干净可选用的试剂是BaCl2(填化学式).
(5)NaClO3和MnO2在一定条件下都可以氧化浓盐酸制取氯气,制取等量的氯气消耗NaClO3与MnO2的物质的量之比为1:3.
(6)工业上可以以石墨为电极电解酸化的硫酸锰制取二氧化锰,该过程的阳极反应式为Mn2+-2e-+2H2O=MnO2+4H+.
II.KMnO4的制备和性质:
(7)实验室由二氧化锰制备高锰酸钾可分二步进行:
第一步:MnO2与KOH共熔并通入氧气:2MnO2+4KOH+O2=2K2MnO4+2H2O
第二步:通入CO2,可使K2MnO4发生歧化反应生成KMnO4和MnO2.
第二步完成反应时,转化为KMnO4的K2MnO4占其全部的百分率约为66.7%(精确到0.1%)
(8)该小组同学为了探究KMnO4溶液和Na2C2O4溶液的反应过程,将酸性KMnO4溶液逐滴滴入一定体积的Na2C2O4溶液中(温度相同,并不断振荡),记录的现象如表:
下列说法中错误的是( )
①请将MnO4-氧化C2O42-的离子方程式补充完整:
2MnO4-+C2O42-+16H+=2Mn2++10CO2↑+8H2O
②请分析KMnO4溶液褪色时间变化的可能原因反应生成的Mn2+对反应有催化作用,且c(Mn2+)浓度大催化效果更好.
I.MnO2的制备:
该学习小组设计了将粗MnO2(含有较多的MnO、MnCO3和Fe2O3)样品转化为纯MnO2实验,其工艺流程如图:

请回答下列问题:
(1)第①步操作中,生成CO2的化学方程式为MnCO3+H2SO4=MnSO4+H2O+CO2↑.
(2)第②步操作中,NaClO3氧化MnSO4的离子方程式为2ClO3-+5Mn2++4H2O=5MnO2+Cl2↑+8H+.
(3)第③步操作中,最终得到的固体除NaClO3外,还一定含有下列物质中的ad(填序号).
a.NaCl b.NaClO c.NaClO4 d.NaOH
(4)为得到纯净的MnO2,须将过滤后的MnO2合并后进行洗涤.洗涤沉淀所用的玻璃仪器有:烧杯、漏斗、玻璃棒,判断是否洗涤干净可选用的试剂是BaCl2(填化学式).
(5)NaClO3和MnO2在一定条件下都可以氧化浓盐酸制取氯气,制取等量的氯气消耗NaClO3与MnO2的物质的量之比为1:3.
(6)工业上可以以石墨为电极电解酸化的硫酸锰制取二氧化锰,该过程的阳极反应式为Mn2+-2e-+2H2O=MnO2+4H+.
II.KMnO4的制备和性质:
(7)实验室由二氧化锰制备高锰酸钾可分二步进行:
第一步:MnO2与KOH共熔并通入氧气:2MnO2+4KOH+O2=2K2MnO4+2H2O
第二步:通入CO2,可使K2MnO4发生歧化反应生成KMnO4和MnO2.
第二步完成反应时,转化为KMnO4的K2MnO4占其全部的百分率约为66.7%(精确到0.1%)
(8)该小组同学为了探究KMnO4溶液和Na2C2O4溶液的反应过程,将酸性KMnO4溶液逐滴滴入一定体积的Na2C2O4溶液中(温度相同,并不断振荡),记录的现象如表:
| 起始加入量(mol) | 平衡时 | ||||
| A | B | C | A或C转化率(%) | C的物质的量分数(%) | 放出或吸收热量(KJ) |
| 1 | 1 | 0 | α1 | φ1 | Q1 |
| 0 | 0 | 2 | α2 | φ2 | Q2 |
| 2 | 2 | 0 | α2 | φ3 | Q3 |
①请将MnO4-氧化C2O42-的离子方程式补充完整:
2MnO4-+C2O42-+16H+=2Mn2++10CO2↑+8H2O
②请分析KMnO4溶液褪色时间变化的可能原因反应生成的Mn2+对反应有催化作用,且c(Mn2+)浓度大催化效果更好.
1.将一铁、铜混合物粉末平均分成三等份,分别加入到同浓度、不同体积的稀硝酸中,充分反应后,收集到NO气体的体积及剩余固体的质量如表 (设反应前后溶液的体积不变,气体体积已换算为标准状况时的体积):
下列说法正确的是( )
| 实验序号号 | 稀硝酸的体积/mL | 剩余固体的质量/g | NO的体积/L |
| 1 | 100 | 17.2 | 2.24 |
| 2 | 200 | 8.00 | 4.48 |
| 3 | 400 | 0 | V |
| A. | 表中 V=7.84 L | |
| B. | 原混合物粉末的质量为25.6 g | |
| C. | 原混合物粉未中铁和铜的物质的量之比为2:3 | |
| D. | 实验3所得溶液中硝酸的物质的量浓度为0.875 mol•L-1 |
8.某学生记录数据如下:
依据该学生的实验数据计算,该实验测得的中和热△H=-51.8kJ/mol.
| 实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | 氢氧化钠 | 混合溶液 | |
| 1 | 20.0 | 20.1 | 23.2 |
| 2 | 20.2 | 20.4 | 23.4 |
| 3 | 20.5 | 20.6 | 23.6 |
5.下列化学用语正确的是( )
| A. | 丙烯的实验式:C3H6 | B. | CO2的电子式: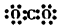 | ||
| C. | 镁离子的结构示意图: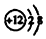 | D. | 中子数为18 的氯原子符号:1718Cl |
6.日本福岛核电站发生核泄漏,对周围土地、海域产生影响.我国东部沿海地区先后检测出放射性物质131I,含量较低,对人们的生活、健康没有造成影响.下列对131I的叙述错误的是( )
| A. | 131I的质量数为131 | B. | 1mol 131I的质量为131 | ||
| C. | 131I原子核外有5个电子层 | D. | 131I核外最外层电子数为7e- |

 .
. .写出反应⑥的化学方程式(注明必要的反应条件):
.写出反应⑥的化学方程式(注明必要的反应条件): +CH3OH$→_{△}^{浓H_{2}SO_{4}}$
+CH3OH$→_{△}^{浓H_{2}SO_{4}}$ .
.