题目内容
18.下列分子中含有的电子数目与HF相同,且分子中只有2个σ键的是( )| A. | H2O | B. | CO2 | C. | N2O | D. | CH4 |
分析 根据原子序数判断原子的电子数目,HF含有10个电子;单键中含有一个σ键,双键中含有一个σ键和一个π键,据此分析.
解答 解:A.H2O中H原子的电子数为2,O原子的电子数为8,H2O分子中含有的电子数目为10,含有的电子数目与HF相同;分子中含有2个单键,即只有2个σ键,故A正确;
B.CO2中C原子的电子数为6,O原子的电子数为8,CO2分子中含有的电子数目为22;分子中含有2个C=O,即含有2个σ键和2个π键,故B错误;
C.N2O中N原子的电子数为7,O原子的电子数为8,N2O分子中含有的电子数目为22;分子中含有2个N=O,即含有2个σ键和2个π键,故C错误;
D.CH4中C原子的电子数为6,H原子的电子数为1,CH4分子中含有的电子数目为10;分子中含有4个单键,即只有4个σ键,故D错误.
故选A.
点评 本题考查原子的结构以及共价键组组成和分类,题目较为简单,注意共价键的分类:单键中含有一个σ键,双键中含有一个σ键和一个π键,侧重于考查学生对基础知识的应用能力.

练习册系列答案
相关题目
8.某学生记录数据如下:
依据该学生的实验数据计算,该实验测得的中和热△H=-51.8kJ/mol.
| 实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | 氢氧化钠 | 混合溶液 | |
| 1 | 20.0 | 20.1 | 23.2 |
| 2 | 20.2 | 20.4 | 23.4 |
| 3 | 20.5 | 20.6 | 23.6 |
9.下列离子方程式书写正确的是( )
| A. | C12与水反应:C12+H2O═2H++Cl-+ClO- | |
| B. | AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ | |
| C. | Fe跟HCl溶液反应:Fe+2H+═Fe2++H2↑ | |
| D. | BaCO3与盐酸反应:CO32-+2 H+═H2O+CO2↑ |
6.日本福岛核电站发生核泄漏,对周围土地、海域产生影响.我国东部沿海地区先后检测出放射性物质131I,含量较低,对人们的生活、健康没有造成影响.下列对131I的叙述错误的是( )
| A. | 131I的质量数为131 | B. | 1mol 131I的质量为131 | ||
| C. | 131I原子核外有5个电子层 | D. | 131I核外最外层电子数为7e- |
13.下列试剂不能贮存在无色透明玻璃试剂瓶里的是( )
| A. | 硫酸铜溶液 | B. | NaOH溶液 | C. | 硝酸 | D. | 水玻璃 |
10.活动小组同学采用如图装置制备并测定所得固体中亚硝酸钠(NaNO2)的质量分数(装置可重复使用,部分夹持仪器已省略).
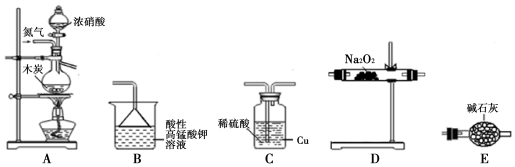
已知:①2NO+Na2O2═2NaNO2;
②酸性条件下,NO、NO2都能与MnO4-反应生成NO3-和Mn2+;NaNO2能使
酸性高锰酸钾溶液褪色.
(1)实验装置的连接顺序为ACEDEB;
(2)C瓶内发生反应的离子方程式为Cu+2H++NO2=Cu2++NO+H2O.
(3)为了测定亚硝酸钠的含量,称取4.0g样品溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.10mol•L-1的酸性KMnO4溶液进行滴定,实验所得数据如表.
①第一组实验数据出现较明显异常,造成异常的原因可能是ac(填字母序号).
a.酸式滴定管用蒸馏水洗净后未用标准液润洗
b.锥形瓶用蒸馏水洗净后未干燥
c.观察滴定终点时仰视读数
②根据表中数据进行计算,所制得的固体中亚硝酸钠的质量分数为86.25%.
(4)设计实验,比较0.1mol•L-1NaNO2溶液中NO2-的水解程度和0.1mol•L-1HNO2溶液中HNO2电离程度的相对大小25℃时,将两种溶液等体积混合,若混合溶液的pH<7,则说明HNO2的电离程度大于NO2-的水解程度;若pH>7,则说明HNO2的电离程度小于NO2-的水解程度(简要说明实验步骤、现象和结论,仪器和药品自选).

已知:①2NO+Na2O2═2NaNO2;
②酸性条件下,NO、NO2都能与MnO4-反应生成NO3-和Mn2+;NaNO2能使
酸性高锰酸钾溶液褪色.
(1)实验装置的连接顺序为ACEDEB;
(2)C瓶内发生反应的离子方程式为Cu+2H++NO2=Cu2++NO+H2O.
(3)为了测定亚硝酸钠的含量,称取4.0g样品溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.10mol•L-1的酸性KMnO4溶液进行滴定,实验所得数据如表.
| 滴定次数 | 1 | 2 | 3 | 4 |
| KMnO4溶液体积/mL | 20.60 | 20.02 | 20.00 | 19.98 |
a.酸式滴定管用蒸馏水洗净后未用标准液润洗
b.锥形瓶用蒸馏水洗净后未干燥
c.观察滴定终点时仰视读数
②根据表中数据进行计算,所制得的固体中亚硝酸钠的质量分数为86.25%.
(4)设计实验,比较0.1mol•L-1NaNO2溶液中NO2-的水解程度和0.1mol•L-1HNO2溶液中HNO2电离程度的相对大小25℃时,将两种溶液等体积混合,若混合溶液的pH<7,则说明HNO2的电离程度大于NO2-的水解程度;若pH>7,则说明HNO2的电离程度小于NO2-的水解程度(简要说明实验步骤、现象和结论,仪器和药品自选).
7.元素的性质主要表现在原子半径、主要化合价、元素的金属性、元素的非金属性等方面、下列有关元素性质的说法中正确的是( )
| A. | 同一周期元素形成的简单离子的半径从左到右依次减小 | |
| B. | 主族元素的最高正价均等于其族序数 | |
| C. | 元素的非金属性、金属性与元素原子在氧化还原反应中得失电子数目的多少无关 | |
| D. | 元素的非金属性越强,其气态氢化物的还原性越弱,其气态氢化物的酸性也越弱 |
17.NA代表阿伏加德罗常数,下列说法正确的是( )
| A. | 2.3g钠由原子变成离子时,失去的电子数为0.2 NA | |
| B. | 0.2 NA个硫酸分子与19.6g磷酸(H3PO4)含有相同的氧原子数 | |
| C. | 28g氮气所含的原子数为NA | |
| D. | NA个氧分子与NA个氢分子的质量比为8:1 |
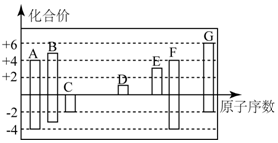 如图是部分短周期元素的常见化合价与原子序数的关系:
如图是部分短周期元素的常见化合价与原子序数的关系: ,其所含化学键类型为离子键和非极性键.
,其所含化学键类型为离子键和非极性键.