题目内容
20.NiCl2是化工合成中最重要的镍源,工业上以金属镍废料(含Fe、Ca、Mg等杂质)为原料生产NiCl2,继而生产Ni2O3的工艺流程如图:
已知:1.Ksp( CaF2)=1.5×10-10Ksp(MgF2)=7.4×10-11Ksp(NiCO3)=1.42×10-7
2.流程中相关金属离子生成氢氧化物沉淀的pH如表所示:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 开始沉淀的pH | 1.1 | 6.5 | 7.1 |
| 沉淀完全的pH | 3.2 | 9.7 | 9.2 |
(2)加入H2O2时发生主要反应的离子方程式为2Fe2++H2O2+2H+═2Fe3++2H2O.
(3)“除铁”时,控制溶液pH的范围为3.2~7.1.
(4)滤渣B的主要成分的化学式为MgF2、CaF2.
(5)确保沉镍完全(即溶液中c(Ni2+)<1.0×10-6),保持溶液中c(CO32-)>0.142mol•L-1.
(6)“氧化”生成Ni2O3的离子方程式为2Ni2++ClO-+4OH-=Ni2O3↓+Cl-+2H2O.
分析 金属镍废料(含Fe、Ca、Mg等杂质),加盐酸酸浸后的酸性溶液中主要含有Ni2+、Cl-,另含有少量Fe2+、Ca2+、Mg2+等,加入过氧化氢氧化亚铁离子为铁离子,加入碳酸钠溶液调节溶液的pH,使铁离子全部沉淀,滤渣A为Fe(OH)3,过滤后的滤液中再加入氟化铵沉淀Ca2+、Mg2+,滤渣B为MgF2、CaF2,再次过滤后向滤液中加入碳酸钠沉淀镍离子得NiCO3,将NiCO3再溶于盐酸,得氯化镍溶液,向其中加入次氯酸钠和氢氧化钠溶液可得Ni2O3.
(1)升高温度、增大酸的浓度、充分搅拌、增大接触面积等可以提高浸出的速率;
(2)过氧化氢氧化亚铁离子为铁离子,还原产物为水,据此写出离子方程式;
(3)除铁时三价铁离子要沉淀完全,而镍离子不能沉淀;
(4)过滤后的滤液中再加入氟化铵沉淀Ca2+、Mg2+;
(5)根据Qc>Ksp时,溶液过饱和计算c(CO32-)的范围;
(6)Cl元素由+1价降低到-1价,即反应生成NaCl,而Ni由+2价升高到+3价,根据原子守恒与电子转移守恒配平.
解答 解:(1)为了提高金属镍废料浸出的速率,还可以增大盐酸的浓度(或将镍废料研成粉末或延长浸泡时间等),
故答案为:增大盐酸的浓度(或将镍废料研成粉末或延长浸泡时间等);
(2)过氧化氢氧化亚铁离子为铁离子,还原产物为水,离子方程式为2Fe2++H2O2+2H+═2Fe3++2H2O,
故答案为:2Fe2++H2O2+2H+═2Fe3++2H2O;
(3)除铁时三价铁离子要沉淀完全,而镍离子不能产生沉淀,所以溶液的PH值控制在3.2~7.1,
故答案为:3.2~7.1;
(4)过滤后的滤液中再加入氟化铵沉淀Ca2+、Mg2+,滤渣B为MgF2、CaF2,
故答案为:MgF2、CaF2;
(5)Ksp(NiCO3)=1.42×10-7,镍离子完全沉淀时,溶液中c(Ni2+)<1.0×10-6mol/L,应保持溶液中c(CO32-)>$\frac{{K}_{sp}(NiC{O}_{3})}{c(N{i}^{2+})}$>$\frac{1.42×1{0}^{-7}}{1.0×1{0}^{-6}}$=0.142mol/L,
故答案为:0.142;
(6)Cl元素由+1价降低到-1价,即反应生成NaCl,而Ni由+2价升高到+3价,生成Ni2O3,反应离子方程式为:2Ni2++ClO-+4OH-=Ni2O3↓+Cl-+2H2O,
故答案为:2Ni2++ClO-+4OH-=Ni2O3↓+Cl-+2H2O.
点评 本题考查物质分离和提纯的方法和基本操作综合应用,涉及反应速率影响因素、条件控制、陌生方程式书写、信息获取能力等,是高考常考题型,是对学生综合能力的考查,题目难度中等.

| 选项 | 实验操作 | 现象 | 结论 |
| A | 将乙醇加入酸性重铬酸钾(K2Cr2O7)溶液中 | 橙色溶液变为绿色 | 乙醇具有还原性 |
| B | 将铜粉加入1.0mol•L-1Fe2(SO4)3溶液中 | 溶液变为蓝色 | 金属铁比铜活泼 |
| C | 将光亮的镁条放入NH4Cl溶液中 | 有大量气泡产生 | 反应生成H2和NH3 |
| D | 将NaAlO2溶液加入NaHCO3溶液中 | 有白色沉淀生成 | AlO2-结合H+的能力比HCO3-强 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 光纤通信使用的光缆的主要成分是晶体Si,太阳能电池使用的材枓主要是SiO2 | |
| B. | 水玻璃可用作防火剂或防腐剂 | |
| C. | 高锰酸钾溶液、SO2、双氧水都能杀菌消毒,消毒原理相同,都利用了强氧化性 | |
| D. | SO2可用来漂白纸浆、毛、丝、草帽辫、增白食品等 |
| A. | “暖冰”中的水分子存在π键 | |
| B. | 水变成“暖冰”,体积会变小 | |
| C. | 在电场作用下,水分子间更易形成氢键,因而可以制得“暖冰” | |
| D. | -个水分子与其他水分子间只能形成2个氢键 |
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向稀HNO3中加入过量铁粉,再滴入少量KSCN溶液 | 溶液变红 | 稀HNO3将Fe氧化为Fe3+ |
| B | 向AgNO3溶液中滴加过量氨水 | 溶液澄清 | Ag+与NH3•H2O能大量共存 |
| C | 将可调高度的铜丝伸入到稀HNO3中 | 溶液变蓝 | Cu与稀HNO3发生置换反应 |
| D | 将KI和FeCl3溶液在试管中混合后,加入CCl4,振荡,静置 | 下层溶液显紫红色 | 氧化性:Fe3+>I2 |
| A. | A | B. | B | C. | C | D. | D |
| 选项 | 现象或事实 | 解释 |
| A. | 肉制品中添加适量的亚硝酸钠 | 亚硝酸钠有防腐的作用 |
| B. | 液氨常用作制冷剂 | 液氨汽化时要吸收大量的热 |
| C. | 利用静电除尘装置除去粉尘 | 胶体粒子带电 |
| D. | Al(OH)3用作塑料的阻燃剂 | Al(OH)3受热熔化吸收大量的热 |
| A. | A | B. | B | C. | C | D. | D |

 $→_{②H+}^{①浓KOH、△}$
$→_{②H+}^{①浓KOH、△}$ +
+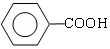
 .
. ,该反应的反应类型是缩聚反应.
,该反应的反应类型是缩聚反应. +4Ag(NH3)2++4OH-$\stackrel{△}{→}$
+4Ag(NH3)2++4OH-$\stackrel{△}{→}$ +2NH4++6NH3+4Ag↓+2H2O.
+2NH4++6NH3+4Ag↓+2H2O. 中任意一种.
中任意一种. .
. Mg-H2O2电池可用于驱动无人驾驶的潜航器.该电池以海水为电解质溶液,其工作原理如图所示.电池总反应是:Mg+H2O2+2H+═Mg2++2H2O
Mg-H2O2电池可用于驱动无人驾驶的潜航器.该电池以海水为电解质溶液,其工作原理如图所示.电池总反应是:Mg+H2O2+2H+═Mg2++2H2O