题目内容
4.化学与社会、生活密切相关,对下列现象或亊实的解释不正确的是( )| 选项 | 现象或事实 | 解释 |
| A. | 肉制品中添加适量的亚硝酸钠 | 亚硝酸钠有防腐的作用 |
| B. | 液氨常用作制冷剂 | 液氨汽化时要吸收大量的热 |
| C. | 利用静电除尘装置除去粉尘 | 胶体粒子带电 |
| D. | Al(OH)3用作塑料的阻燃剂 | Al(OH)3受热熔化吸收大量的热 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.亚硝酸钠具有防腐的作用;
B.液氨气化吸收大量的热;
C.带电的胶体粒子具有电泳的性质;
D.氢氧化铝易分解.
解答 解:A.亚硝酸钠具有防腐的作用,但对人体有害,应加入适量,故A正确;
B.氨气易液化,且液氨气化吸收大量的热,可用作制冷剂,故B正确;
C.带电的胶体粒子具有电泳的性质,可用电泳的性质进行除尘,故C正确;
D.氢氧化铝易分解,吸收大量的热,防止塑料燃烧,故D错误.
故选D.
点评 本题考查较为综合,涉及食品安全、材料的使用等知识,侧重于基础知识的综合考查和运用,为高考常见题型和高频考点,注意相关基础知识的积累,难度不大.

练习册系列答案
相关题目
20.NiCl2是化工合成中最重要的镍源,工业上以金属镍废料(含Fe、Ca、Mg等杂质)为原料生产NiCl2,继而生产Ni2O3的工艺流程如图:

已知:1.Ksp( CaF2)=1.5×10-10Ksp(MgF2)=7.4×10-11Ksp(NiCO3)=1.42×10-7
2.流程中相关金属离子生成氢氧化物沉淀的pH如表所示:
(1)为了提高镍元素的浸出率,在“酸浸”时可采取的措施有:增大盐酸的浓度(或将镍废料研成粉末或延长浸泡时间等)(写出一种即可).
(2)加入H2O2时发生主要反应的离子方程式为2Fe2++H2O2+2H+═2Fe3++2H2O.
(3)“除铁”时,控制溶液pH的范围为3.2~7.1.
(4)滤渣B的主要成分的化学式为MgF2、CaF2.
(5)确保沉镍完全(即溶液中c(Ni2+)<1.0×10-6),保持溶液中c(CO32-)>0.142mol•L-1.
(6)“氧化”生成Ni2O3的离子方程式为2Ni2++ClO-+4OH-=Ni2O3↓+Cl-+2H2O.

已知:1.Ksp( CaF2)=1.5×10-10Ksp(MgF2)=7.4×10-11Ksp(NiCO3)=1.42×10-7
2.流程中相关金属离子生成氢氧化物沉淀的pH如表所示:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 开始沉淀的pH | 1.1 | 6.5 | 7.1 |
| 沉淀完全的pH | 3.2 | 9.7 | 9.2 |
(2)加入H2O2时发生主要反应的离子方程式为2Fe2++H2O2+2H+═2Fe3++2H2O.
(3)“除铁”时,控制溶液pH的范围为3.2~7.1.
(4)滤渣B的主要成分的化学式为MgF2、CaF2.
(5)确保沉镍完全(即溶液中c(Ni2+)<1.0×10-6),保持溶液中c(CO32-)>0.142mol•L-1.
(6)“氧化”生成Ni2O3的离子方程式为2Ni2++ClO-+4OH-=Ni2O3↓+Cl-+2H2O.
15.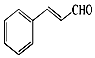 自然界中的许多植物中含有醛,其中有些具有特殊的香味,可作为植物香料使用.桂皮中含有肉桂醛,结构如图,杏仁中含有苯甲醛.以下说法错误的是( )
自然界中的许多植物中含有醛,其中有些具有特殊的香味,可作为植物香料使用.桂皮中含有肉桂醛,结构如图,杏仁中含有苯甲醛.以下说法错误的是( )
 自然界中的许多植物中含有醛,其中有些具有特殊的香味,可作为植物香料使用.桂皮中含有肉桂醛,结构如图,杏仁中含有苯甲醛.以下说法错误的是( )
自然界中的许多植物中含有醛,其中有些具有特殊的香味,可作为植物香料使用.桂皮中含有肉桂醛,结构如图,杏仁中含有苯甲醛.以下说法错误的是( )| A. | 肉桂醛分子中含有两种官能团,分子式为C9H8O | |
| B. | 肉桂醛分子中最多有18个原子共平面 | |
| C. | 1 mol肉桂醛与氢气加成时最多消耗4 mol H2 | |
| D. | 肉桂醛与苯甲醛不是同系物,但都能发生氧化反应和还原反应 |
12.下列有关实验原理或实验操作正确的是( )
| A. | 利用丁达尔效应鉴别FeCl3溶液和Fe(OH)3胶体 | |
| B. | 只能利用焰色反应可鉴别KCl溶液和Na2SO4溶液 | |
| C. | 用水润湿pH试纸测量某溶液的PH | |
| D. | 实验室用NaOH溶液除去Cl2中的少量HCl |
19.PH3一种无色剧毒气体,其分子结构和NH3相似,但P-H键键能比N-H键键能低.下列判断错误的是( )
| A. | PH3分子呈三角锥形 | |
| B. | PH3分子是极性分子 | |
| C. | PH3中P 采取sp2杂化 | |
| D. | PH3分子稳定性低于NH3分子,因为N-H键键能高 |
9.下列说法正确的是( )
| A. | 等质量的铝分别与足量Fe2O3或Fe3O4发生铝热反应时,转移电子的数目相等 | |
| B. | 质量分数分别为40%和60%的硫酸溶液等体积混合,所得溶液的质量分数为50% | |
| C. | 金属钠着火时,立即用泡沫灭火器灭火 | |
| D. | 洗涤做焰色反应的铂丝,可选用稀盐酸或稀硫酸 |
13.阿伏加德罗常数的值为NA.下列说法正确的是( )
| A. | 1L0.1mol•L-1NH4Cl溶液中,NH4+的数量为0.1NA | |
| B. | 2.4gMg与H2SO4完全反应,转移的电子数为0.1NA | |
| C. | 标准状况下,2.24LN2和O2的混合气体中分子数为0.2NA | |
| D. | 0.1mol H2和0.1mol I2于密闭容器中充分反应后,其分子总数为0.2NA |
13. 全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其中电极a常用掺有石墨烯的S8材料,电池反应为:16Li+xS8=8Li2Sx(2≤x≤8).下列说法错误的是( )
全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其中电极a常用掺有石墨烯的S8材料,电池反应为:16Li+xS8=8Li2Sx(2≤x≤8).下列说法错误的是( )
 全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其中电极a常用掺有石墨烯的S8材料,电池反应为:16Li+xS8=8Li2Sx(2≤x≤8).下列说法错误的是( )
全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其中电极a常用掺有石墨烯的S8材料,电池反应为:16Li+xS8=8Li2Sx(2≤x≤8).下列说法错误的是( )| A. | 电池工作时,正极可发生反应:2Li2S6+2Li++2e-=3Li2S4 | |
| B. | 电池工作时,外电路中流过0.02 mol电子,负极材料减重0.14 g | |
| C. | 石墨烯的作用主要是提高电极a的导电性 | |
| D. | 电池充电时间越长,电池中的Li2S2量越多 |
 ; B与D组成的三原子分子的结构式为O=C=O.
; B与D组成的三原子分子的结构式为O=C=O.