题目内容
11.某有机物A,其分子式为C5H10O2.已知1mol A与足量的钠反应可生成标况下22.4L的H2,A不能使溴的CCl4溶液褪色,其分子结构中无甲基,且同一个碳原子上只连有一个官能团,符合以上条件的A的同分异构体有( )| A. | 9种 | B. | 10种 | C. | 11种 | D. | 12种 |
分析 某有机物A,其分子式为C5H10O2.不饱和度为1,A不能使溴的CCl4溶液褪色,说明没有碳碳双键或碳碳三键,再根据1mol A与足量的钠反应可生成标况下22.4L的H2,说明分子中含有1个羟基、1个羧基,可以看成羟基取代戊酸上的氢原子,注意同一个碳原子上只连有一个官能团;
解答 解:某有机物A,其分子式为C5H10O2.不饱和度为1,A不能使溴的CCl4溶液褪色,说明没有碳碳双键或碳碳三键,再根据1mol A与足量的钠反应可生成标况下22.4L的H2,说明分子中含有1个羟基、1个羧基,戊酸的同分异构体有:HOOCCH2CH2CH2CH3,HOOCCH(CH3)CH2CH3,HOOCCH2CH(CH3)CH3,HOOCC(CH3)3,用羟基取代戊酸上的氢原子,且同一个碳原子上只连有一个官能团的异构体分别有:3种、3种、2种、1种,故选A.
点评 本题考查有机物的结构与性质,把握官能团与性质的关系为解答的关键,侧重分析与推断能力的考查,注意羧酸、醇、烯烃的性质,题目难度不大.

练习册系列答案
相关题目
1.运用化学反应原理研究碳、氮、硫元素及其化合物有重要意义.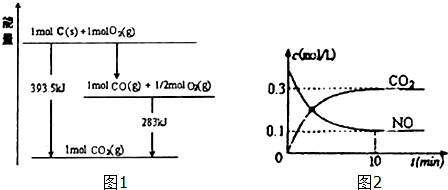
(1)已知一定量的C单质能在O2(g)中燃烧,其可能的产物及能量关系如图1所示:
写出CO2(g)与C(s)反应生成CO(g)的热化学方程式CO2(g)+C(s)=2CO(g)△H=+172.5kJ/mol.
(2)汽车尾气净化过程中发生反应2NO(g)+2CO(g)?N2+2CO2(g)△H<0.一定条件下,向某密闭恒容容器中按体积比1:l充入44.8L,(标准状况)NO和CO混合气体,发生上述反应,某同学根据反应过程中的有关数据绘制了如图2所示曲线.
①下列关于上述反应过程的叙述正确的是AD(填写字母代号).
A.其它条件不变,加入催化剂,△H的值不变
B.及时除去二氧化碳,反应的正反应速率加快
C.NO、CO、N2、CO2浓度均不再变化,说明未达到平衡状态
D.混合气体的平均相对分子质量不再改变,证明反应达到化学平衡状态
②前10min内CO的平均反应速率为0.03mol/(L•min),达平衡时NO的转化率为75%,能使上述平衡体系中$\frac{n(C{O}_{2})}{n(NO)}$增大的措施有降低温度或加压或增大CO的物质的量或从体系中分离出N2(任写一条).
(3)已知弱电解质在水中的电离平衡常数(25℃)如下表(单位省略):
①室温条件下.用敞口容器加热氨水一段时间,恢复至室温后,溶液中水的电离程度比加热前增大(填写“增大”、“减小”或“不变”).
②常温下,测得某碳酸饮料的pH=6,则该饮料$\frac{n(C{O}_{3}^{2-})}{n(HC{O}_{3}^{-})}$=5.6×10-5.

(1)已知一定量的C单质能在O2(g)中燃烧,其可能的产物及能量关系如图1所示:
写出CO2(g)与C(s)反应生成CO(g)的热化学方程式CO2(g)+C(s)=2CO(g)△H=+172.5kJ/mol.
(2)汽车尾气净化过程中发生反应2NO(g)+2CO(g)?N2+2CO2(g)△H<0.一定条件下,向某密闭恒容容器中按体积比1:l充入44.8L,(标准状况)NO和CO混合气体,发生上述反应,某同学根据反应过程中的有关数据绘制了如图2所示曲线.
①下列关于上述反应过程的叙述正确的是AD(填写字母代号).
A.其它条件不变,加入催化剂,△H的值不变
B.及时除去二氧化碳,反应的正反应速率加快
C.NO、CO、N2、CO2浓度均不再变化,说明未达到平衡状态
D.混合气体的平均相对分子质量不再改变,证明反应达到化学平衡状态
②前10min内CO的平均反应速率为0.03mol/(L•min),达平衡时NO的转化率为75%,能使上述平衡体系中$\frac{n(C{O}_{2})}{n(NO)}$增大的措施有降低温度或加压或增大CO的物质的量或从体系中分离出N2(任写一条).
(3)已知弱电解质在水中的电离平衡常数(25℃)如下表(单位省略):
| 弱电解质 | H2CO3 | NH3•H2O |
| 电离平衡常数 | Ka1=4.2×10-7 Ka2=5.6×10-11 | 1.7×10-5 |
②常温下,测得某碳酸饮料的pH=6,则该饮料$\frac{n(C{O}_{3}^{2-})}{n(HC{O}_{3}^{-})}$=5.6×10-5.
2.全氮类物质具有高密度、超高能量及爆轰产物无污染等优点.中国科学家成功合成全氮阴离子N5-,N5-是制备全氮类物质N5+N5-的重要中间体.下列说法中,不正确的是( )
| A. | 全氮类物质属于绿色能源 | B. | 每个N5+中含有35个质子 | ||
| C. | 每个N5-中含有35个电子 | D. | N5+N5-结构中含共价键 |
6.下列实验“操作和现象”与“结论”对应且正确的是( )
| 选项 | 操作和现象 | 结论 |
| A | 将少量溴水加入KI溶液中,充分反应后再加入CCl4,振荡,静置,下层液体呈紫色 | 氧化性:Br2>I2 |
| B | 常温下,打磨后的铝片放入HNO3中,无明显现象 | 常温下,铝不与浓HNO3反应 |
| C | 向一定量AgNO3溶液中,先滴加KCl溶液,再滴加KI溶液,先出现白色沉淀,后出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| D | 用pH计测定NaF溶液和CH3COONa溶液可知:pH(NaF)<pH(CH3COONa) | 酸性:HF>CH3COOH |
| A. | A | B. | B | C. | C | D. | D |
16.下列脱水过程中不属于取代反应的是( )
①高级脂肪酸与甘油脱水形成油脂 ②乙醇在浓H2SO4作用下脱水制乙烯
③氨基酸在酶的作用下脱水形成二肽 ④葡萄糖在浓H2SO4作用下脱水成焦炭.
①高级脂肪酸与甘油脱水形成油脂 ②乙醇在浓H2SO4作用下脱水制乙烯
③氨基酸在酶的作用下脱水形成二肽 ④葡萄糖在浓H2SO4作用下脱水成焦炭.
| A. | ①② | B. | ①③ | C. | ②③ | D. | ②④ |
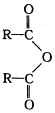
2.酚醛树脂材料具有绝缘、隔热、难燃等性能,合成酚醛树脂反应如图:
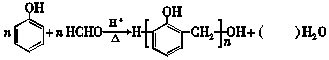
下列说法正确的是( )

下列说法正确的是( )
| A. | 方程式中水的化学计量数是 2n-1 | |
| B. | 常温下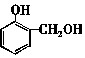 比 比 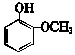 更难溶于水 更难溶于水 | |
| C. | 1 mol HCHO与银氨溶液反应最多可以生成2 mol Ag | |
| D. |  的单体是 的单体是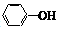 和HCHO 和HCHO |
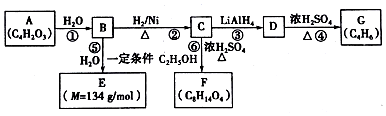
 $\stackrel{H_{2}O}{→}$2RCOOH(其中R是烃基)
$\stackrel{H_{2}O}{→}$2RCOOH(其中R是烃基)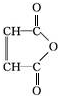 .
.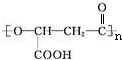 .有机物Y与E互为同分异构体,且具有相同的官能团种类和数目,则Y的结构可有2种.
.有机物Y与E互为同分异构体,且具有相同的官能团种类和数目,则Y的结构可有2种.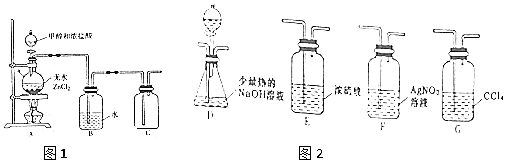
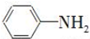 )有还原性,易被氧化;
)有还原性,易被氧化;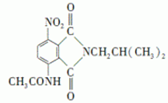 .
.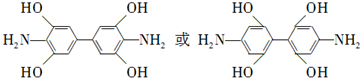 .
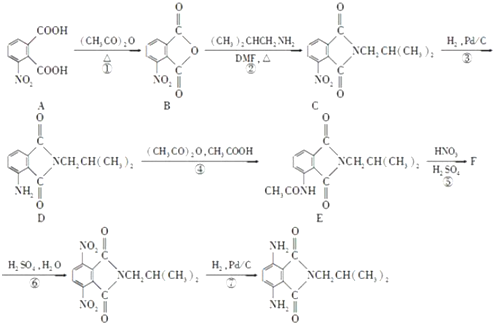
.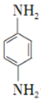 是一种重要的染料中间体.根据已有知识并结合相关信息,写出以苯、(CH3CO)2O及CH3COOH为主要有机原料制备对苯二胺的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
是一种重要的染料中间体.根据已有知识并结合相关信息,写出以苯、(CH3CO)2O及CH3COOH为主要有机原料制备对苯二胺的合成路线流程图(无机试剂任用).合成路线流程图示例如下: