题目内容
15.下列有关元素性质的叙述,不正确的是( )| A. | HF、HCl、HBr、HI的稳定性逐渐减弱 | |
| B. | C、N、O、F的最高正化合价逐渐增大 | |
| C. | KOH、NaOH、Mg(OH)2、Al(OH)3的碱性逐渐减弱 | |
| D. | SiH4、PH3、H2S、HCl的还原性逐渐减弱 |
分析 A.同主族元素从上到下非金属性逐渐减弱,元素的非金属性越强,对应的氢化物越稳定;
B.O、F元素无正价;
C.元素的金属性越强,对应的最高价氧化物的水化物的碱性越强;
D.元素的非金属性越强,对应的氢化物还原性越弱.
解答 解:A.非金属性F>Cl>Br>I,元素的非金属性越强,对应的氢化物越稳定,则HF、HCl、HBr、HI的稳定性逐渐减弱,故A正确;
B.O、F元素的非金属性较强,无正价,故B错误;
C.金属性K>Na>Mg>Al,元素的金属性越强,对应的最高价氧化物的水化物的碱性越强,则KOH、NaOH、Mg(OH)2、Al(OH)3的碱性逐渐减弱,故C正确;
D.非金属性Cl>S>P>Si,元素的非金属性越强,对应的氢化物还原性越弱,则SiH4、PH3、H2S、HCl的还原性逐渐减弱,故D正确.
故选B.
点评 本题考查元素周期表和周期律,为高频考点,把握元素的位置、性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案
相关题目
5.下列有关物质的性质或该物质性质的应用均正确的是( )
| A. | 醋酸与醋酸钠溶液中的醋酸根均可以水解,同浓度时前者的水解程度比后者低一些 | |
| B. | 明矾净水与自来水的杀菌清毒原理是相同的 | |
| C. | MgO和Al2O3常用于制作耐高温材料,工业上采用电解此两种物质冶炼镁、铝金属 | |
| D. | 氯化亚铁溶液加热蒸干并灼烧得到三氧化二铁 |
6.根据图回答,下列说法错误的是( )
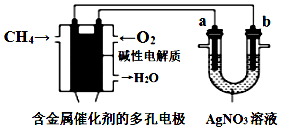

| A. | 电子经导线流入b电极 | |
| B. | 若b极增重5.4 g时,燃料电池负极消耗CH4的体积为140 mL | |
| C. | 燃料电池中正极反应为O2+4e-+2H2O═4OH- | |
| D. | 此装置用于电镀银时,一段时间后硝酸银溶液的浓度不变 |
3.化学与生产、生活息息相关,下列有关说法正确的是( )
| A. | Na2SiO3水溶液俗称水玻璃,是制备硅胶和木材防火剂的原料 | |
| B. | 为防止食品氧化,常在食品袋中放入装有CaO的透气小袋 | |
| C. | 油脂在人体内水解为氨基酸和甘油等小分子被吸收 | |
| D. | 生产有机玻璃的主要原料为纯碱、石英和石灰石 |
1.运用化学反应原理研究碳、氮、硫元素及其化合物有重要意义.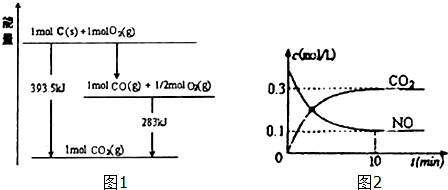
(1)已知一定量的C单质能在O2(g)中燃烧,其可能的产物及能量关系如图1所示:
写出CO2(g)与C(s)反应生成CO(g)的热化学方程式CO2(g)+C(s)=2CO(g)△H=+172.5kJ/mol.
(2)汽车尾气净化过程中发生反应2NO(g)+2CO(g)?N2+2CO2(g)△H<0.一定条件下,向某密闭恒容容器中按体积比1:l充入44.8L,(标准状况)NO和CO混合气体,发生上述反应,某同学根据反应过程中的有关数据绘制了如图2所示曲线.
①下列关于上述反应过程的叙述正确的是AD(填写字母代号).
A.其它条件不变,加入催化剂,△H的值不变
B.及时除去二氧化碳,反应的正反应速率加快
C.NO、CO、N2、CO2浓度均不再变化,说明未达到平衡状态
D.混合气体的平均相对分子质量不再改变,证明反应达到化学平衡状态
②前10min内CO的平均反应速率为0.03mol/(L•min),达平衡时NO的转化率为75%,能使上述平衡体系中$\frac{n(C{O}_{2})}{n(NO)}$增大的措施有降低温度或加压或增大CO的物质的量或从体系中分离出N2(任写一条).
(3)已知弱电解质在水中的电离平衡常数(25℃)如下表(单位省略):
①室温条件下.用敞口容器加热氨水一段时间,恢复至室温后,溶液中水的电离程度比加热前增大(填写“增大”、“减小”或“不变”).
②常温下,测得某碳酸饮料的pH=6,则该饮料$\frac{n(C{O}_{3}^{2-})}{n(HC{O}_{3}^{-})}$=5.6×10-5.

(1)已知一定量的C单质能在O2(g)中燃烧,其可能的产物及能量关系如图1所示:
写出CO2(g)与C(s)反应生成CO(g)的热化学方程式CO2(g)+C(s)=2CO(g)△H=+172.5kJ/mol.
(2)汽车尾气净化过程中发生反应2NO(g)+2CO(g)?N2+2CO2(g)△H<0.一定条件下,向某密闭恒容容器中按体积比1:l充入44.8L,(标准状况)NO和CO混合气体,发生上述反应,某同学根据反应过程中的有关数据绘制了如图2所示曲线.
①下列关于上述反应过程的叙述正确的是AD(填写字母代号).
A.其它条件不变,加入催化剂,△H的值不变
B.及时除去二氧化碳,反应的正反应速率加快
C.NO、CO、N2、CO2浓度均不再变化,说明未达到平衡状态
D.混合气体的平均相对分子质量不再改变,证明反应达到化学平衡状态
②前10min内CO的平均反应速率为0.03mol/(L•min),达平衡时NO的转化率为75%,能使上述平衡体系中$\frac{n(C{O}_{2})}{n(NO)}$增大的措施有降低温度或加压或增大CO的物质的量或从体系中分离出N2(任写一条).
(3)已知弱电解质在水中的电离平衡常数(25℃)如下表(单位省略):
| 弱电解质 | H2CO3 | NH3•H2O |
| 电离平衡常数 | Ka1=4.2×10-7 Ka2=5.6×10-11 | 1.7×10-5 |
②常温下,测得某碳酸饮料的pH=6,则该饮料$\frac{n(C{O}_{3}^{2-})}{n(HC{O}_{3}^{-})}$=5.6×10-5.
18.某学生用 Na2CO3和 KHCO3 组成的某混合物进行实验,测得如表数据(盐酸的物质的量浓度相等且不考虑HCl的挥发)下列有关的说法中,正确的是( )
| 实验序号 | ① | ② | ③ | ④ |
| 盐酸体积/mL | 50 | 50 | 50 | 50 |
| 固体质量/g | 3.06 | 6.12 | 9.18 | 12.24 |
| 生成气体体积/L(标况) | 0.672 | 1.344 | 1.568 | 1.344 |
| A. | 盐酸的物质的量浓度为 2 mol•L-1 | |
| B. | 原混合物样品中 n(Na2CO3):n(KHCO3)=1:1 | |
| C. | 实验②中,混合物过量 | |
| D. | 实验④反应后,至少需继续加入 40ml 的该盐酸溶液才能把12.24g 的混合物全部反应 |
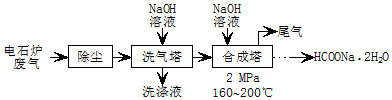
 .
.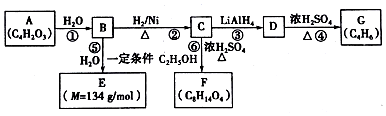
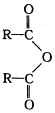 $\stackrel{H_{2}O}{→}$2RCOOH(其中R是烃基)
$\stackrel{H_{2}O}{→}$2RCOOH(其中R是烃基)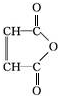 .
.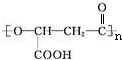 .有机物Y与E互为同分异构体,且具有相同的官能团种类和数目,则Y的结构可有2种.
.有机物Y与E互为同分异构体,且具有相同的官能团种类和数目,则Y的结构可有2种.