题目内容
5. 已知A、B、C、D都是元素周期表中前36号的元素.A元素的一种核素没有中子.B的基态原子核外电子有9种不同的运动状态;C元素是无机非金属材料的主角,它的单质可以用作电脑芯片;D元素是地壳中含量第二的金属元素.请回答:
已知A、B、C、D都是元素周期表中前36号的元素.A元素的一种核素没有中子.B的基态原子核外电子有9种不同的运动状态;C元素是无机非金属材料的主角,它的单质可以用作电脑芯片;D元素是地壳中含量第二的金属元素.请回答:(1)A与C形成的最简单化合物的分子式是SiH4,分子的立体结构是正四面体,难溶 (填“易溶”或“难溶”)于水.
(2)B与C形成的化合物O显负价(填元素符号);B与C形成的化合物
晶体类型是原子晶体.
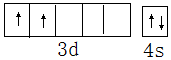
(3)D的+3价离子的价电子排布图为3d5,检验该离子的方法是:取被鉴别的溶液少许于试管中,滴加1-2滴KSCN溶液,若溶液变成血红色,则该溶液中含有Fe3+.
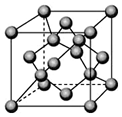
(4)由C原子构成的晶体中微粒间作用力是共价键,如图是由C单质构成的晶体的一个晶胞,若设该晶胞的边长为a cm,NA表示阿伏加德罗常数,则该晶体的密度是$\frac{224}{{N}_{A}{a}^{3}}$g/cm3(只要求列出算式).
分析 A、B、C、D都是元素周期表中前36号的元素.A元素的一种核素没有中子,则A为H元素;B的基态原子核外电子有9种不同的运动状态,则B为F元素;C元素是无机非金属材料的主角,它的单质可以用作电脑芯片,则C为Si;D元素是地壳中含量第二的金属元素,则D为Fe,
(1)A与C形成化合物为SiH4,根据Si原子的价层电子对数判断,结合水分子为极性分子判断;
(2)二氧化硅中,O元素为负价,二氧化硅属于原子晶体;
(3)Fe属于第VIII族元素,亚铁离子核外有24个电子,铁离子核外有23个电子,据此写出其核外电子排布式;通常用硫氰化钾溶液检验铁离子;
(4)非金属单质中原子间以共价键结合;利用均摊法计算晶胞中原子个数,再求出晶胞的质量,然后根据ρ=$\frac{m}{V}$计算
解答 解:A、B、C、D都是元素周期表中前36号的元素.A元素的一种核素没有中子,则A为H元素;B的基态原子核外电子有9种不同的运动状态,则B为F元素;C元素是无机非金属材料的主角,它的单质可以用作电脑芯片,则C为Si;D元素是地壳中含量第二的金属元素,则D为Fe,
(1)A与C形成化合物为SiH4,SiH4中Si原子的价层电子对数为4,没有孤电子对,属于sp3杂化,分子的空间构型为正四面体;SiH4分子结构对称,正负电荷中心重叠属于非极性分子,则SiH4难溶于极性溶剂水,
故答案为:SiH4;正四面体;难溶;
(2)B与C分别为O、Si元素,二者形成的化合物为二氧化硅,二氧化硅中O元素显负价;二氧化硅属于原子晶体,
故答案为:O;原子晶体;
(3)Fe属于第VIII族元素,铁离子核外有23个电子,电子排布式为:1s22s22p63s23p63d5,其价电子排布式为:3d5;
用KSCN溶液检验铁离子具体方法:取被鉴别的溶液少许于试管中,滴加1-2滴KSCN溶液,若溶液变成血红色,则该溶液中含有Fe3+,
故答案为:3d5;取被鉴别的溶液少许于试管中,滴加1-2滴KSCN溶液,若溶液变成血红色,则该溶液中含有Fe3+;
(4)C为硅元素,其单质中硅原子间以共价键结合;晶胞中Si原子的数目为$\frac{1}{8}$×8+$\frac{1}{2}$×6+4=8,则晶胞的质量为:$\frac{8×28}{{N}_{A}}$g,晶胞的体积为V=a3cm3;
所以ρ=$\frac{m}{V}$=$\frac{\frac{8×28}{{N}_{A}}}{{a}^{3}}$g/cm3=$\frac{224}{{N}_{A}{a}^{3}}$g/cm3;
故答案为:共价键;$\frac{224}{{N}_{A}{a}^{3}}$.
点评 本题考查了晶胞计算,涉及晶体类型判断、元素推断、晶胞密度计算等知识,题目难度中等,推断元素为解答关键,注意掌握均摊法在晶胞计算中的应用,试题培养了学生的逻辑推理能力及化学计算能力.

 科学实验活动册系列答案
科学实验活动册系列答案| A. | HCO3- | B. | SO${\;}_{4}^{2-}$ | C. | NH${\;}_{4}^{+}$ | D. | Fe2+ |
| A. | Fe | B. | Al | C. | Cu | D. | Ag |
①NH3的浓度增大,N2和H2的浓度减小②NH3的物质的量增大,N2和H2的物质的量减小③H2的转化率增大,N2的转化率不变④混合气体的平均分子量增大.
| A. | ①④ | B. | ②④ | C. | ①② | D. | ③④ |
| A. | CaO+H2O═Ca(OH)2,可以放出大量的热,故可把该反应设计成原电池,把其中的化学能转化为电能 | |
| B. | 其他条件均相同,带有“盐桥”的原电池比不带“盐桥”的原电池电流持续时间长 | |
| C. | 原电池工作时,正极表面一定有气泡产生 | |
| D. | 钢铁水闸可用牺牲阴极或外加电流的阳极保护法防止其腐蚀 |
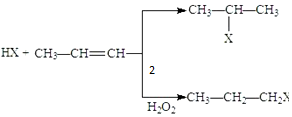 (X为卤素原子)
(X为卤素原子)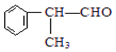 的物质,该物质是一种香料.
的物质,该物质是一种香料.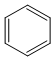 $→_{催化剂}^{①CH_{2}=CH-CH_{3}}$A$→_{一氯代物}^{②光照}$B$\stackrel{③}{→}$C$→_{HCl}^{④}$D$\stackrel{⑤}{→}$E$\stackrel{⑥氧化反应}{→}$
$→_{催化剂}^{①CH_{2}=CH-CH_{3}}$A$→_{一氯代物}^{②光照}$B$\stackrel{③}{→}$C$→_{HCl}^{④}$D$\stackrel{⑤}{→}$E$\stackrel{⑥氧化反应}{→}$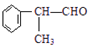
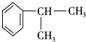 .
.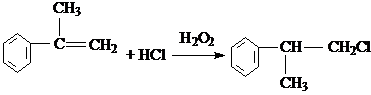 、2
、2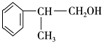 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2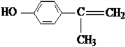 、
、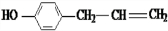 、
、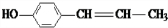 .
.