题目内容
14.在密闭容器中,可逆反应N2+3H2?2NH3达到平衡后,若保持温度不变,缩小容器体积,达到新平衡时,下列说法正确的是( )①NH3的浓度增大,N2和H2的浓度减小②NH3的物质的量增大,N2和H2的物质的量减小③H2的转化率增大,N2的转化率不变④混合气体的平均分子量增大.
| A. | ①④ | B. | ②④ | C. | ①② | D. | ③④ |
分析 合成氨为气体体积减小的反应,则若保持温度不变,缩小容器体积,平衡正向移动,以此来解答.
解答 解:①平衡正向移动NH3的浓度增大,N2和H2的浓度也比原平衡时大,故错误;
②平衡正向移动,NH3的物质的量增大,N2和H2的物质的量减小,故正确;
③平衡正向移动,H2的转化率增大,N2的转化率也增大,故错误;
④气体的质量不变,平衡正向移动,混合气体的物质的量减小,则混合气体的平均分子量增大,故正确;
故选B.
点评 本题考查化学平衡移动,为高频考点,把握体积与压强的关系、压强对平衡移动的影响为解答本题的关键,侧重分析与应用能力的考查,注意平衡移动方向的判断,题目难度不大.

练习册系列答案
 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案
相关题目
4.设NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 在反应KIO3+6HI=KI+3I2+3H2O中,每生成3molI2转移的电子数为6NA | |
| B. | 7.8gNa2O2固体中含有的阴离子数为0.2NA | |
| C. | 标准状况下,体积为2.24 L的CO2和SO2的混合气体中含有的氧原子数为0.2 NA | |
| D. | 0.l mol Cl2参加氧化还原反应,转移的电子数目一定是0.2NA |
2.科学家发现用二氧化钛(TiO2)作催化剂可以使水在光照条件下分解制得廉价的氢气,这使氢能源的研究和应用更向前迈进了一步.下列说法正确的是( )
| A. | 使用二氧化钛作催化剂使水快速分解的同时放出大量热 | |
| B. | 该过程涉及到的反应为氧化还原反应 | |
| C. | 该反应的原理是:2H2O$\frac{\underline{\;通电\;}}{\;}$2H2+O2 | |
| D. | 每产生氢气44.8L,转移电子数目为2NA |
9.下列反应能说明苯环对侧链有影响的是( )
| A. | 对二甲苯与酸性高锰酸钾溶液发生反应;甲烷与酸性高锰酸钾溶液不反应 | |
| B. | 甲苯与浓硝酸和浓硫酸混合液,加热;苯与浓硝酸和浓硫酸混合液,加热 | |
| C. | 乙苯与氢气在催化剂作用下加热反应;苯与氢气在催化剂作用下加热反应 | |
| D. | 邻二甲苯与氯气在光照下发生反应;甲烷在光照下与氯气发生反应 |
19.下列说法不正确的是( )
| A. | Mg(OH)2固体在溶液中存在平衡:Mg(OH)2(s)?Mg2+(aq)+2OH-(aq),该固体可溶于NH4Cl溶液 | |
| B. | 向ZnS沉淀上滴加CuSO4溶液沉淀变为黑色,可推知同温下Ksp(ZnS)<Ksp(CuS) | |
| C. | 向AgCl悬浊液中滴加Na2S溶液,白色沉淀变成黑色,反应方程式为2AgCl(s)+S2-(aq)?Ag2S(s)+2Cl-(aq) | |
| D. | 向2mL浓度均为1.2mol•L-1的KCl、KI混合溶液中滴加1~2滴0.01mol•L-1的AgNO3溶液,振荡沉淀呈黄色,说明Ksp(AgCl)>Ksp(AgI) |
6.以赤铁矿(主要成分为60.0%Fe2O3,杂质有3.6%FeO,Al2O3,MnO2,CuO等)为原料制备高活性铁单质的主要生产流程如图所示:
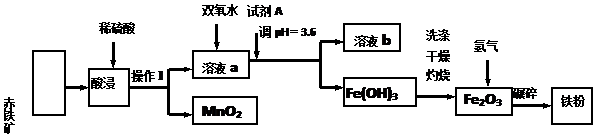
已知部分阳离子以氢氧化物形式完全深沉时溶液的pH如表所示,请回答下列问题:
(1)含杂质的赤铁矿使用前要将其粉碎,目的是增大固液接触面积,加快浸出反应速率,提高浸出率.操作Ⅰ的名称是过滤.
(2)将操作Ⅰ后所得的MnO2与KClO3、KOH溶液混合共热,可得到K2MnO4,此反应的化学方程式是3MnO2+KClO3+6KOH$\frac{\underline{\;\;△\;\;}}{\;}$3K2MnO4+KCl+3H2O.
(3)将PH控制在3.6的目的是使铁离子全部沉淀下来而其他金属离子不沉淀.已知25℃时,Ksp[Cu(OH)2]=2×10-20,该温度下反应Cu2++2H2O?Cu(OH)2+2H+的平衡常数K=5×10-9.
(4)加入双氧水时反应的离子方程式为H2O2+2Fe2++2H+=2Fe3++2H2O.
(5)利用氨气在500℃以上分解得到的氮原子渗透到铁粉中可制备氮化铁(FexVy),若消耗氨气17.0g,消耗赤铁矿石1Kg,写出该反应完整的化学方程式:16Fe+2NH3$\frac{\underline{\;大于500℃\;}}{\;}$2Fe8N+3H2.

已知部分阳离子以氢氧化物形式完全深沉时溶液的pH如表所示,请回答下列问题:
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe (OH)2 | Cu (OH)2 |
| pH | 3.4 | 5.2 | 9.7 | 6.7 |
(2)将操作Ⅰ后所得的MnO2与KClO3、KOH溶液混合共热,可得到K2MnO4,此反应的化学方程式是3MnO2+KClO3+6KOH$\frac{\underline{\;\;△\;\;}}{\;}$3K2MnO4+KCl+3H2O.
(3)将PH控制在3.6的目的是使铁离子全部沉淀下来而其他金属离子不沉淀.已知25℃时,Ksp[Cu(OH)2]=2×10-20,该温度下反应Cu2++2H2O?Cu(OH)2+2H+的平衡常数K=5×10-9.
(4)加入双氧水时反应的离子方程式为H2O2+2Fe2++2H+=2Fe3++2H2O.
(5)利用氨气在500℃以上分解得到的氮原子渗透到铁粉中可制备氮化铁(FexVy),若消耗氨气17.0g,消耗赤铁矿石1Kg,写出该反应完整的化学方程式:16Fe+2NH3$\frac{\underline{\;大于500℃\;}}{\;}$2Fe8N+3H2.
3.下列溶液中粒子物质的量浓度的关系正确的是( )
| A. | pH相同的①NH4Cl②NH4Al(SO4)3③NH4HSO3,三种溶液中的c(NH4+):①<②<③ | |
| B. | 20mL0.1mol/L的CH3COONa溶液与10mL0.1mol/L的HCl溶液混合后呈酸性,所得溶液中:c(CH3COO-)>c(Cl-)>c(CH4COOH)>c(H+) | |
| C. | 0.1mol/L的NaHCO3溶液与0.1mol/L的NaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-) | |
| D. | 常温下,pH=7的NH4Cl与氨水的混合溶液中:c(Cl-)>c(NH4+)>c(H+)=c(OH-) |
4.下列说法中正确的是( )
| A. | 足量的CO2和水蒸气的混合气体与少量的Na2O2充分反应,最终必生成NaOH | |
| B. | 足量的MnO2与含4molHCl的浓盐酸加热充分反应,产生的Cl2必为1mol | |
| C. | 含2molHCl的某盐酸滴入足量的碳酸钠溶液中充分反应后,得到CO2气体必为1mol | |
| D. | 过量的二氧化碳通入偏铝酸钠溶液中,最终生成的产物必为Al(OH)2和碳酸氢钠 |
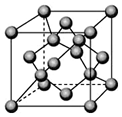 已知A、B、C、D都是元素周期表中前36号的元素.A元素的一种核素没有中子.B的基态原子核外电子有9种不同的运动状态;C元素是无机非金属材料的主角,它的单质可以用作电脑芯片;D元素是地壳中含量第二的金属元素.请回答:
已知A、B、C、D都是元素周期表中前36号的元素.A元素的一种核素没有中子.B的基态原子核外电子有9种不同的运动状态;C元素是无机非金属材料的主角,它的单质可以用作电脑芯片;D元素是地壳中含量第二的金属元素.请回答: