题目内容
6.(1)基态钛原子的价电子排布图为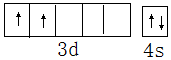
(2)已知TiCl4在通常情况下是无色液体,熔点为-37℃,沸点为136℃,可知TiCl4为分子晶体.
(3)硫酸氧钛晶体中阳离子为链状聚合形式的离子,结构如图1所示.该阳离子Ti与O的原子数之比为1:1.
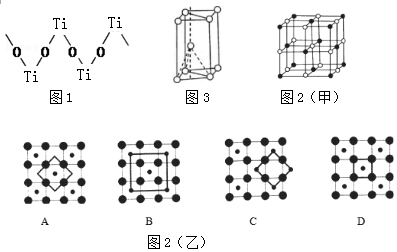
(4)Co的一种氧化物的晶胞如图甲所示,在该晶体中与一个钴原子等距离且最近的钴原子有12个;筑波材料科学国家实验室一个科研小组发现了在5K下呈现超导性的晶体,该晶体具有CoO2的层状结构(如图2乙所示,小球表示Co原子,大球表示O原子).下列用粗线画出的重复结构单元示意图(如图2乙)不能描述CoO2的化学组成是D.
(5)由C、Mg、Ni三种元素组成的一种简单立方结构的化合物具有超导性,其晶胞中C位于体心位置,Mg位于顶角,Ni占据面心位置,该化合物的化学式为MgNi3C,晶体中Mg原子周围距离最近的Ni原子有12个,该新型超导材料晶胞参数a=0.38nm,计算该晶体的密度6.45(g•cm-3)(保留三位有效数字)
(6)金属钛晶胞结构如图3所示,设钛原子的半径为r,则该晶胞体积的表达式为8$\sqrt{2}$r3.
分析 (1)Ti是22号元素,其3d、4s电子为其价电子;
(2)分子晶体的熔沸点较低;
(3)根据图知,每个Ti原子连接2个O原子、每个O原子连接2个Ti原子;
(4)由氧化物晶胞结构可知晶胞中Co、O原子数目之比为1:1,假设黑色球为Co原子,以顶点Co原子为研究对象,与之等距离且最近的钴原子位于面心,每个顶点为8个晶胞共用,每个面心为2个晶胞共用;CoO2的重复结构单元示意图中Co、O原子数目之比应为1:2,结合均摊法计算判断;
(5)该晶胞中C原子个数是1、Mg原子个数=8×$\frac{1}{8}$=1、Ni原子个数=6×$\frac{1}{2}$=3,据此确定其化学式; 晶体中Mg原子周围距离最近的Ni原子个数=3×8÷2;晶胞棱长=0.38nm=0.38×10-7cm,晶胞体积=(0.38×10-7cm)3,晶胞密度=$\frac{m}{V}$;
(6)底面上棱长为2r,底面高=2r×sin60°=$\sqrt{3}$r,
底面上的3个原子和晶胞体内的原子构成正四面体,正四面体的棱长=2r,底面三角形顶点到三角形重心的距离=$\frac{2}{3}$×2r×sin60°=$\frac{2\sqrt{3}}{3}$r,顶点到底面的距离=$\sqrt{(2r)^{2}-(\frac{2\sqrt{3}}{3}r)^{2}}$=$\sqrt{\frac{8}{3}}$r,晶胞高=2×$\sqrt{\frac{8}{3}}$r,则晶胞体积=2r×$\sqrt{3}$r×2×$\sqrt{\frac{8}{3}}$r.
解答 解:(1)Ti是22号元素,其3d、4s电子为其价电子,其价电子排布图为 ,
,
故答案为: ;
;
(2)分子晶体熔沸点较低,该物质的熔沸点较低,则为分子晶体,故答案为:分子;
(3)根据图知,每个Ti原子连接2个O原子、每个O原子连接2个Ti原子,所以Ti、O原子个数之比为1:1,故答案为:1:1;
(4)由氧化物晶胞结构可知晶胞中Co、O原子数目之比为1:1,假设黑色球为Co原子,以顶点Co原子为研究对象,与之等距离且最近的钴原子位于面心,每个顶点为8个晶胞共用,每个面心为2个晶胞共用,在该晶体中与一个钴原子等距离且最近的钴原子数目为3×8÷2=12;
CoO2的重复结构单元示意图中Co、O原子数目之比应为1:2,由图象可知:
A中Co、O原子数目之比为1:4×$\frac{1}{2}$=1:2,符合,
B中Co、O原子数目之比为(1+4×$\frac{1}{4}$):4=1:2,符合,
C中Co、O原子数目之比为(4×$\frac{1}{4}$):(4×$\frac{1}{2}$)=1:2,符合,
D中Co、O原子数目之比为1:4×$\frac{1}{4}$=1:1,不符合,
故答案为:12;D;
(5)该晶胞中C原子个数是1、Mg原子个数=8×$\frac{1}{8}$=1、Ni原子个数=6×$\frac{1}{2}$=3,据此确定其化学式为MgNi3C; 晶体中Mg原子周围距离最近的Ni原子个数=3×8÷2=12;晶胞棱长=0.38nm=0.38×10-7cm,晶胞体积=(0.38×10-7cm)3,晶胞密度=$\frac{m}{V}$=$\frac{\frac{213}{{N}_{A}}}{(0.38×1{0}^{-7})^{3}}$ g•cm-3=6.45 g•cm-3,
故答案为:MgNi3C; 12;6.45;
(6)底面上棱长为2r,底面高=2r×sin60°=$\sqrt{3}$r,
底面上的3个原子和晶胞体内的原子构成正四面体,正四面体的棱长=2r,底面三角形顶点到三角形重心的距离=$\frac{2}{3}$×2r×sin60°=$\frac{2\sqrt{3}}{3}$r,顶点到底面的距离=$\sqrt{(2r)^{2}-(\frac{2\sqrt{3}}{3}r)^{2}}$=$\sqrt{\frac{8}{3}}$r,晶胞高=2×$\sqrt{\frac{8}{3}}$r,则晶胞体积=2r×$\sqrt{3}$r×2×$\sqrt{\frac{8}{3}}$r=8$\sqrt{2}$r3,
故答案为:8$\sqrt{2}$r3.
点评 本题考查较综合,涉及晶胞计算、解题类型判断、原子核外电子排布等知识点,侧重考查学生分析、判断、空间想象及计算能力,明确晶胞中原子排列方式是解本题关键,难点是(6)题计算,注意该晶胞不是正立方体,底面是菱形而不是正方形结构,其晶体结构如图 ,题目难点中等.
,题目难点中等.

| A. | 前者生成的水少 | B. | 前者对环境的污染小 | ||
| C. | 前者燃烧产生的热量多 | D. | 前者消耗氧气量少 |
| A. | 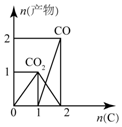 图:n(O2)=1mol,高温下C和O2在密闭容器中的反应产物 | |
| B. | 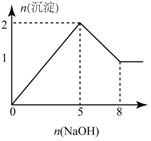 图:向含有1molMgCl2和1molAlCl3混合溶液中滴加NaOH,产生沉淀物质的量 | |
| C. | 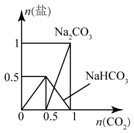 图:n(NaOH)=1mol,CO2逐步通入到NaOH溶液中反应生成的盐 | |
| D. | 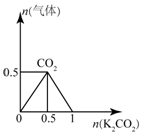 图:n(HCl)=1mol,K2CO3逐步加入到HCl溶液中,在敲口容器中生成的气体 |
①H++Z-+XO4-═X2++Z1+H2O
②2A2++B2═2A3++2B-
③2B-+Z2═B2+2Z-
由此判断下列说法中不正确的是( )
| A. | 反应Z2+2A2+═2A3++2Z-能够进行 | |
| B. | Z元素在①③反应中均被氧化 | |
| C. | 反应①的离子方程式为:16H++10Z-+2XO4-═2X2++5Z2+8H2O | |
| D. | 氧化性由强到弱的顺序是XO4-、Z2、B2、A3+ |
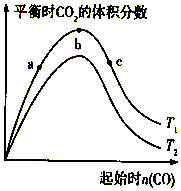 燃煤脱硫可减少SO2尾气的排放,燃煤脱硫技术受到各界科研人员的关注.一种燃煤脱硫技术的原理是:CaO(s)+3CO(g)+SO2(g)?CaS(s)+3CO2(g)△H=-394.0kJ/mol.保持其他条件不变,不同温度下起始CO物质的量与平衡时体系中CO2的体积分数的关系如图所示(T表示温度):下列有关说法正确的是( )
燃煤脱硫可减少SO2尾气的排放,燃煤脱硫技术受到各界科研人员的关注.一种燃煤脱硫技术的原理是:CaO(s)+3CO(g)+SO2(g)?CaS(s)+3CO2(g)△H=-394.0kJ/mol.保持其他条件不变,不同温度下起始CO物质的量与平衡时体系中CO2的体积分数的关系如图所示(T表示温度):下列有关说法正确的是( )| A. | T1比T2高 | |
| B. | b点SO2转化率最高 | |
| C. | b点后曲线下降是因CO体积分数升高 | |
| D. | 减小压强可提高CO、SO2转化率 |
| A. | 在反应KIO3+6HI=KI+3I2+3H2O中,每生成3molI2转移的电子数为6NA | |
| B. | 7.8gNa2O2固体中含有的阴离子数为0.2NA | |
| C. | 标准状况下,体积为2.24 L的CO2和SO2的混合气体中含有的氧原子数为0.2 NA | |
| D. | 0.l mol Cl2参加氧化还原反应,转移的电子数目一定是0.2NA |
 甲醇可以与水蒸气反应生成氢气,反应方程式如下:
甲醇可以与水蒸气反应生成氢气,反应方程式如下: 已知A、B、C、D都是元素周期表中前36号的元素.A元素的一种核素没有中子.B的基态原子核外电子有9种不同的运动状态;C元素是无机非金属材料的主角,它的单质可以用作电脑芯片;D元素是地壳中含量第二的金属元素.请回答:
已知A、B、C、D都是元素周期表中前36号的元素.A元素的一种核素没有中子.B的基态原子核外电子有9种不同的运动状态;C元素是无机非金属材料的主角,它的单质可以用作电脑芯片;D元素是地壳中含量第二的金属元素.请回答: