题目内容
17.5.6g铁放入100mL FeCl3溶液中,恰好完全反应,求原FeCl3溶液及反应后所得溶液的物质的量浓度(不考虑溶液体积的变化).分析 恰好完全反应,发生Fe+2FeCl3=3FeCl2,n(Fe)=$\frac{5.6g}{56g/mol}$=0.1mol,结合反应及c=$\frac{n}{V}$计算.
解答 解:n(Fe)=$\frac{5.6g}{56g/mol}$=0.1mol,发生Fe+2FeCl3=3FeCl2,可知n(FeCl3)=0.2mol,n(FeCl2)=0.3mol,则原FeCl3溶液的浓度为$\frac{0.2mol}{0.1L}$=2mol/L,反应后所得溶液的物质的量浓度为$\frac{0.3mol}{0.1L}$=3mol/L,
答:原FeCl3溶液及反应后所得溶液的物质的量浓度分别为2mol/L、3mol/L.
点评 本题考查化学反应的计算,为高频考点,把握发生的反应、物质的量关系为解答本题的关键,侧重分析与计算能力的考查,注意溶液体积不变,题目难度不大.

练习册系列答案
 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案
相关题目
8.将ag Na放入水中,完全反应后要使所得溶液中每b个水分子中溶有1个Na+,需水的量为( )
| A. | $\frac{ab}{23}$mol | B. | $\frac{a(b+1)}{23}$mol | C. | $\frac{18ab}{23}$g | D. | $\frac{18a(b+1)}{23}$mol |
12.某混合物,可能含有以下几种离子:K+、Cl-、NH4+、Mg2+、CO32-、Ba2+、SO42-,若将该混合物溶于水可得澄清溶液,现取3份各100mL该溶液分别进行如下实验:
试回答下列问题:
(1)根据实验1对Cl-是否存在的判断是不能确定(填“一定存在”“一定不存在”或“不能确定”);根据实验1~3判断混合物中一定不存在的离子是Ba2+、Mg2+.
(2)试确定溶液中一定存在的阴离子及其物质的量浓度((可以不填满,也可以增加)):
(3)试确定K+是否存在?存在,如果存在,c(K+)溶液中肯定存在的离子是NH4+、CO32-和SO42-,经计算,NH4+的物质的量为0.05 mol,CO32-、SO42-的物质的量分别为0.01 mol和0.02 mol,根据电荷守恒得K+一定存在,且钾离子的物质的量浓度为:≥0.1mol/l,如果不存在,理由是、.
| 实验 序号 | 实验内容 | 实验结果 |
| 1 | 加AgNO3溶液 | 有白色沉淀生成 |
| 2 | 加足量NaOH溶液并加热 | 收集到气体1.12L(已折算成标准状况下的体积) |
| 3 | 加足量BaCl2溶液时,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后干燥、称量 | 第一次称量读数为6.63g,第二次称量读数为4.66g |
(1)根据实验1对Cl-是否存在的判断是不能确定(填“一定存在”“一定不存在”或“不能确定”);根据实验1~3判断混合物中一定不存在的离子是Ba2+、Mg2+.
(2)试确定溶液中一定存在的阴离子及其物质的量浓度((可以不填满,也可以增加)):
| 阴离子符号 | 物质的量浓度(mol/L) |
2.科学家发现用二氧化钛(TiO2)作催化剂可以使水在光照条件下分解制得廉价的氢气,这使氢能源的研究和应用更向前迈进了一步.下列说法正确的是( )
| A. | 使用二氧化钛作催化剂使水快速分解的同时放出大量热 | |
| B. | 该过程涉及到的反应为氧化还原反应 | |
| C. | 该反应的原理是:2H2O$\frac{\underline{\;通电\;}}{\;}$2H2+O2 | |
| D. | 每产生氢气44.8L,转移电子数目为2NA |
9.下列反应能说明苯环对侧链有影响的是( )
| A. | 对二甲苯与酸性高锰酸钾溶液发生反应;甲烷与酸性高锰酸钾溶液不反应 | |
| B. | 甲苯与浓硝酸和浓硫酸混合液,加热;苯与浓硝酸和浓硫酸混合液,加热 | |
| C. | 乙苯与氢气在催化剂作用下加热反应;苯与氢气在催化剂作用下加热反应 | |
| D. | 邻二甲苯与氯气在光照下发生反应;甲烷在光照下与氯气发生反应 |
6.以赤铁矿(主要成分为60.0%Fe2O3,杂质有3.6%FeO,Al2O3,MnO2,CuO等)为原料制备高活性铁单质的主要生产流程如图所示:
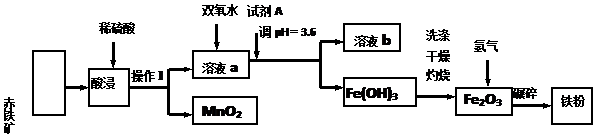
已知部分阳离子以氢氧化物形式完全深沉时溶液的pH如表所示,请回答下列问题:
(1)含杂质的赤铁矿使用前要将其粉碎,目的是增大固液接触面积,加快浸出反应速率,提高浸出率.操作Ⅰ的名称是过滤.
(2)将操作Ⅰ后所得的MnO2与KClO3、KOH溶液混合共热,可得到K2MnO4,此反应的化学方程式是3MnO2+KClO3+6KOH$\frac{\underline{\;\;△\;\;}}{\;}$3K2MnO4+KCl+3H2O.
(3)将PH控制在3.6的目的是使铁离子全部沉淀下来而其他金属离子不沉淀.已知25℃时,Ksp[Cu(OH)2]=2×10-20,该温度下反应Cu2++2H2O?Cu(OH)2+2H+的平衡常数K=5×10-9.
(4)加入双氧水时反应的离子方程式为H2O2+2Fe2++2H+=2Fe3++2H2O.
(5)利用氨气在500℃以上分解得到的氮原子渗透到铁粉中可制备氮化铁(FexVy),若消耗氨气17.0g,消耗赤铁矿石1Kg,写出该反应完整的化学方程式:16Fe+2NH3$\frac{\underline{\;大于500℃\;}}{\;}$2Fe8N+3H2.

已知部分阳离子以氢氧化物形式完全深沉时溶液的pH如表所示,请回答下列问题:
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe (OH)2 | Cu (OH)2 |
| pH | 3.4 | 5.2 | 9.7 | 6.7 |
(2)将操作Ⅰ后所得的MnO2与KClO3、KOH溶液混合共热,可得到K2MnO4,此反应的化学方程式是3MnO2+KClO3+6KOH$\frac{\underline{\;\;△\;\;}}{\;}$3K2MnO4+KCl+3H2O.
(3)将PH控制在3.6的目的是使铁离子全部沉淀下来而其他金属离子不沉淀.已知25℃时,Ksp[Cu(OH)2]=2×10-20,该温度下反应Cu2++2H2O?Cu(OH)2+2H+的平衡常数K=5×10-9.
(4)加入双氧水时反应的离子方程式为H2O2+2Fe2++2H+=2Fe3++2H2O.
(5)利用氨气在500℃以上分解得到的氮原子渗透到铁粉中可制备氮化铁(FexVy),若消耗氨气17.0g,消耗赤铁矿石1Kg,写出该反应完整的化学方程式:16Fe+2NH3$\frac{\underline{\;大于500℃\;}}{\;}$2Fe8N+3H2.
 甲醇可以与水蒸气反应生成氢气,反应方程式如下:
甲醇可以与水蒸气反应生成氢气,反应方程式如下: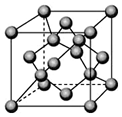 已知A、B、C、D都是元素周期表中前36号的元素.A元素的一种核素没有中子.B的基态原子核外电子有9种不同的运动状态;C元素是无机非金属材料的主角,它的单质可以用作电脑芯片;D元素是地壳中含量第二的金属元素.请回答:
已知A、B、C、D都是元素周期表中前36号的元素.A元素的一种核素没有中子.B的基态原子核外电子有9种不同的运动状态;C元素是无机非金属材料的主角,它的单质可以用作电脑芯片;D元素是地壳中含量第二的金属元素.请回答: