题目内容
11.200mL5mol/L的Na2CO3溶液中,含有的Na+数是( )| A. | 1 | B. | 2 | C. | 6.02×1023 | D. | 1.204×1024 |
分析 依据n=CV计算碳酸钠的物质的量,1mol碳酸钠含有2mol钠离子,据此解答;
解答 解:200mL5mol/L的Na2CO3溶液中,含有碳酸钠的物质的量为:0.2L×5mol/L=1mol,含有钠离子物质的量为2mol,数目2mol×6.02×1023mol-1=1.204×1024,
故选:D.
点评 本题考查了物质的量有关计算,明确以物质的量为核心的计算公式是解题关键,题目难度不大.

练习册系列答案
相关题目
1.下列物质中氧原子数目与11.7g Na2O2中氧原子的数目一定相等的是( )
| A. | 4.2 g CO | B. | 6.6 g CO2 | C. | 8 g SO2 | D. | 9.8 g H2SO4 |
19.下列电离方程式中正确的是( )
| A. | Al2(SO4)3═2Al3++3SO42- | B. | FeCl2═Fe2++3Cl- | ||
| C. | H2SO4═H2++SO42- | D. | Ca(OH)2═Ca2++2(OH-) |
16.对已达化学平衡的反应3H2(g)+N2 (g)?2NH3(g)△H<0,降低温度对化学平衡的影响是( )
| A. | 正、逆反应速率都减小,平衡向正反应方向移动 | |
| B. | 正、逆反应速率都增大,平衡向正反应方向移动 | |
| C. | 逆反应速率増大,正反应速率减小,平衡向逆反应方向移动 | |
| D. | 逆反应速率减小,正反应速率増大,平衡向正反应方向移动 |
3.恒温时,在密闭容器中进行可逆反应:N2+3H2?2NH3,达到平衡后,欲使正反应速率增大,可采取的措施是( )
| A. | 缩小容器的容积 | |
| B. | 保持容器的容积不变,通入稀有气体 | |
| C. | 保持容器内压强不变,通入稀有气体 | |
| D. | 及时把生成的NH3分离出去 |
15.下列比较项与依据的化学反应事实对应的是( )
| 比较项 | 依据的化学反应事实 | |
| A | 比较Cl和S的非金属性 | Na2S+2HCl=2NaCl+H2S↑ |
| B | 比较Fe2+和Br-的还原性 | 2FeBr2+3Cl2(过量)=2FeCl3+2Br2 |
| C | 比较氯化银和碘化银溶解度 | AgCl(s)+I-少量(aq)=AgI(s)+Cl-(aq) |
| D | 比较硝酸和硫酸的酸性 | 3Cu+8HNO3(稀)═3Cu(NO3)2+4H2O+2NO↑ Cu和H2SO4(稀)不反应 |
| A. | A | B. | B | C. | C | D. | D |
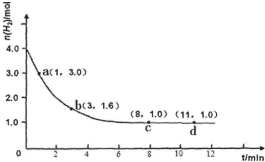 工业合成氨的反应为:N2(g)+3H2(g)?2NH3(g)△H<0某实验将3.0mol N2(g)和4.0mol H2(g)充入容积为10L的密闭容器中,在温度T1下反应.测得H2的物质的量随反应时间的变化如图所示.
工业合成氨的反应为:N2(g)+3H2(g)?2NH3(g)△H<0某实验将3.0mol N2(g)和4.0mol H2(g)充入容积为10L的密闭容器中,在温度T1下反应.测得H2的物质的量随反应时间的变化如图所示.