题目内容
6.4.5g水与24.5g磷酸(H3PO4)所含的分子数相等,它们所含的氧原子数之比是1:4.分析 先根据n=$\frac{m}{M}$计算出水的物质的量,分子数相同时二者的物质的量相等,然后根据m=nM计算出需要磷酸的物质的量;最后根据N=NA计算出含有O原子的物质的量.
解答 解:4.5g水的物质的量为:n(H2O)=$\frac{4.5g}{18g/mol}$=0.25mol,与磷酸的分子数相同,则物质的量相同,则n(H3PO4)=0.25mol,m(H3PO4)=0.25mol×98g/mol=24.5g;
它们所含氧原子数之比是(0.25mol):(4×0.25mol)=1:4,
故答案为:24.5;1:4.
点评 本题考查了物质的量的计算,题目难度不大,明确物质的量与摩尔质量、阿伏伽德罗常数之间的关系即可解答,试题侧重基础知识的考查,有利于提高学生的化学计算能力.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
16.同种物质中同一价态的元素部分被氧化,部分被还原的氧化还原反应是( )
| A. | SO2+2H2S═S+2H2O | B. | 2NaNO3$\frac{\underline{\;\;△\;\;}}{\;}$2NaNO2+O2↑ | ||
| C. | NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$N2O↑+2H2O | D. | 3Cl2+6KOH═5KCl+KClO3+3H2O |
11.200mL5mol/L的Na2CO3溶液中,含有的Na+数是( )
| A. | 1 | B. | 2 | C. | 6.02×1023 | D. | 1.204×1024 |
9.二氧化硫是一种重要的化工原料,主要用于生产硫酸、亚硫酸盐等.请回答:
(1)已知2SO2(g)+O2(g)?2SO3(g)是工业制硫酸的关键反应.如图1为不同温度(T1、T2)下SO2的转化率随时间的变化曲线.

①T1>(填“>”“<”或“=”)T2,判断的依据是温度越高反应速率越快,达到化学平衡的时间越短;该反应为放(填“放”或“吸”)热反应,判断的依据是温度升高时平衡向吸热方向移动,SO2的转化率减小.
②如表为一定温度和压强下,4种投料比[n(SO2):n(O2)]分别为2:18、4:15、7:11和8:10时SO2的平衡转化率.
i.b对应的投料比为4:15.
ii.投料比为8:10时,平衡混合气体中SO3体积分数为50%.
(2)钠碱循环法吸收硫酸厂尾气中的SO2并将其转化为硫酸的工艺如图2:
①吸收池中发生反应的离子方程式是SO2+SO32-+H2O=2HSO3-.
②电解池的构造示意图如图3:
i.在图中标示出b区的Na+和HSO3-的移动方向.
ii.请结合生成H2SO4的电极反应式说明c区除得到浓的硫酸外,还会得到什么物质:SO2.
(1)已知2SO2(g)+O2(g)?2SO3(g)是工业制硫酸的关键反应.如图1为不同温度(T1、T2)下SO2的转化率随时间的变化曲线.

①T1>(填“>”“<”或“=”)T2,判断的依据是温度越高反应速率越快,达到化学平衡的时间越短;该反应为放(填“放”或“吸”)热反应,判断的依据是温度升高时平衡向吸热方向移动,SO2的转化率减小.
②如表为一定温度和压强下,4种投料比[n(SO2):n(O2)]分别为2:18、4:15、7:11和8:10时SO2的平衡转化率.
| 投料比 | a | b | c | d |
| SO2平衡转化率/% | 97.1 | 96.8 | 95.8 | 90.0 |
ii.投料比为8:10时,平衡混合气体中SO3体积分数为50%.
(2)钠碱循环法吸收硫酸厂尾气中的SO2并将其转化为硫酸的工艺如图2:
①吸收池中发生反应的离子方程式是SO2+SO32-+H2O=2HSO3-.
②电解池的构造示意图如图3:
i.在图中标示出b区的Na+和HSO3-的移动方向.
ii.请结合生成H2SO4的电极反应式说明c区除得到浓的硫酸外,还会得到什么物质:SO2.
10.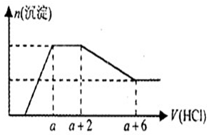 某溶液中可能含有OH-,CO32-,AlO2-,SiO32-,SO42-,Na+,Fe3+,Mg2+,Al3+等离子,当向溶液中逐滴加入一定物质的量的盐酸时,生成沉淀物质的量与加入盐酸体积的关系如图所示.下列判断正确的是( )
某溶液中可能含有OH-,CO32-,AlO2-,SiO32-,SO42-,Na+,Fe3+,Mg2+,Al3+等离子,当向溶液中逐滴加入一定物质的量的盐酸时,生成沉淀物质的量与加入盐酸体积的关系如图所示.下列判断正确的是( )
 某溶液中可能含有OH-,CO32-,AlO2-,SiO32-,SO42-,Na+,Fe3+,Mg2+,Al3+等离子,当向溶液中逐滴加入一定物质的量的盐酸时,生成沉淀物质的量与加入盐酸体积的关系如图所示.下列判断正确的是( )
某溶液中可能含有OH-,CO32-,AlO2-,SiO32-,SO42-,Na+,Fe3+,Mg2+,Al3+等离子,当向溶液中逐滴加入一定物质的量的盐酸时,生成沉淀物质的量与加入盐酸体积的关系如图所示.下列判断正确的是( )| A. | 原溶液中一定含有Na2SO4 | |
| B. | 反应后形成的溶液溶质为NaCl | |
| C. | 原溶液中含有CO32-与AlO2-的物质的量比为1:1 | |
| D. | 原溶液中一定含有的离子是OH-,CO32-,SiO32-,AlO2- |
