题目内容
15.下列比较项与依据的化学反应事实对应的是( )| 比较项 | 依据的化学反应事实 | |
| A | 比较Cl和S的非金属性 | Na2S+2HCl=2NaCl+H2S↑ |
| B | 比较Fe2+和Br-的还原性 | 2FeBr2+3Cl2(过量)=2FeCl3+2Br2 |
| C | 比较氯化银和碘化银溶解度 | AgCl(s)+I-少量(aq)=AgI(s)+Cl-(aq) |
| D | 比较硝酸和硫酸的酸性 | 3Cu+8HNO3(稀)═3Cu(NO3)2+4H2O+2NO↑ Cu和H2SO4(稀)不反应 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.比较元素的非金属性,可从元素对应的最高价氧化物的水化物的酸性强弱的角度比较;
B.与同一氧化剂反应时,物质的还原性越强,越易被氧化;
C.从难溶电解质的溶解平衡的角度分析;
D.稀硝酸氧化性强于稀硫酸.
解答 解:A.若从酸性的角度比较Cl和S的非金属性,所用试剂应是元素对应的最高价氧化物的水化物,不能用氢化物的酸性进行比较,故A错误;
B.通入少量Cl2,Fe2+先被氧化,说明Fe2+的还原性大于Br-,如果通入过量氯气,则二价铁离子、溴离子都被氧化,无法判断,故B错误;
C.AgCl中加入I-(aq)生成AgI,可说明AgI比AgCl难溶,故C正确;
D.3Cu+8HNO3(稀)═3Cu(NO3)2+4H2O+2NO↑,Cu和H2SO4(稀)不反应,说明稀硝酸的氧化性强于稀硫酸,不能说明二者酸性,故D错误;
故选:C.
点评 本题考查化学性质检验的设计,题目难度中等,易错点为A,注意比较非金属性强弱的角度.

练习册系列答案
相关题目
11.200mL5mol/L的Na2CO3溶液中,含有的Na+数是( )
| A. | 1 | B. | 2 | C. | 6.02×1023 | D. | 1.204×1024 |
6.在三个体积相同的密闭容器中分别充入Ne、H2、O2三种气体,当它们的温度和密度都相同时,这三种气体的压强(p)从大到小的是( )
| A. | p (Ne)>p (H2)>p (O2) | B. | p (O2)>p (Ne)>p (H2) | C. | p (H2)>p (O2)>p (Ne) | D. | p (H2)>p (Ne)>p (O2) |
3.橙花醛是一种香料,其结构简式为(CH3)2C═CHCH2CH2C(CH3)═CHCHO.下列说法正确的是( )
| A. | 橙花醛不能与Br2发生加成反应 | |
| B. | 橙花醛能发生银镜反应 | |
| C. | 1 mol橙花醛最多可以与2 mol H2发生加成反应 | |
| D. | 橙花醛是乙烯的同系物 |
10.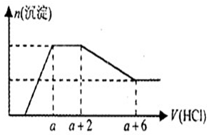 某溶液中可能含有OH-,CO32-,AlO2-,SiO32-,SO42-,Na+,Fe3+,Mg2+,Al3+等离子,当向溶液中逐滴加入一定物质的量的盐酸时,生成沉淀物质的量与加入盐酸体积的关系如图所示.下列判断正确的是( )
某溶液中可能含有OH-,CO32-,AlO2-,SiO32-,SO42-,Na+,Fe3+,Mg2+,Al3+等离子,当向溶液中逐滴加入一定物质的量的盐酸时,生成沉淀物质的量与加入盐酸体积的关系如图所示.下列判断正确的是( )
 某溶液中可能含有OH-,CO32-,AlO2-,SiO32-,SO42-,Na+,Fe3+,Mg2+,Al3+等离子,当向溶液中逐滴加入一定物质的量的盐酸时,生成沉淀物质的量与加入盐酸体积的关系如图所示.下列判断正确的是( )
某溶液中可能含有OH-,CO32-,AlO2-,SiO32-,SO42-,Na+,Fe3+,Mg2+,Al3+等离子,当向溶液中逐滴加入一定物质的量的盐酸时,生成沉淀物质的量与加入盐酸体积的关系如图所示.下列判断正确的是( )| A. | 原溶液中一定含有Na2SO4 | |
| B. | 反应后形成的溶液溶质为NaCl | |
| C. | 原溶液中含有CO32-与AlO2-的物质的量比为1:1 | |
| D. | 原溶液中一定含有的离子是OH-,CO32-,SiO32-,AlO2- |
7.有NO、CO2、N2O4三种气体,它们分别都含有0.5mol氧原子,则三种气体的物质的量之比为( )
| A. | 1:2:4 | B. | 1:1:1 | C. | 4:2:1 | D. | 1:2:4 |
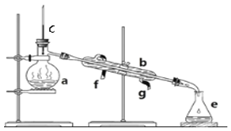 掌握仪器名称、组装及使用方法是中学化学实验的基础,如图为实验装置.
掌握仪器名称、组装及使用方法是中学化学实验的基础,如图为实验装置.