题目内容
T℃时,A气体与B气体反应生成C气体.反应过程中A、B、C浓度变化如图(Ⅰ)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示,则下列结论正确的是( )


| A、在t1min时,3V正(B)=2V逆(C) |
| B、(t1+10)min时,保持容器总压强不变,通入稀有气体,平衡向正反应方向移动 |
| C、T℃时,在相同容器中,若由0.3mol?L-1A、0.1 mol?L-1 B和0.4 mol?L-1 C反应,达到平衡后,C的浓度仍为0.4 mol?L-1 |
| D、其他条件不变,升高温度,正、逆反应速率均增大,且A的转化率增大 |
考点:体积百分含量随温度、压强变化曲线
专题:
分析:该反应达到平衡状态时,A浓度的变化量=(0.5-0.3)mol/L=0.2mol/L,B浓度的变化量=(0.7-0.1)mol/L=0.6mol/L,C浓度的变化量=(0.4-0)mol/L=0.4mol/L,同一化学反应同一时间段内,各物质浓度的变化量之比等于其计量数之比,所以该反应方程式为:A(g)+3B(g)?2C(g),
根据“先拐先平数值大”结合图II知,T1>T2,升高温度,B的体积发生增大,则该反应的正反应是放热反应;
A.在t1min时,反应达到平衡状态,正逆反应速率相等,根据A(g)+3B(g)?2C(g),2V正(B)=3V逆(C);
B.其它条件不变,升高温度,正逆反应速率都增大,平衡向吸热反应方向移动;
C.先根据图Ⅰ计算平衡常数,再根据平衡常数计算改变三种物质的浓度达到平衡状态时C的浓度;
D.根据“先拐先平数值大”结合图Ⅱ知,T1>T2,升高温度,平衡向吸热反应方向移动;
根据“先拐先平数值大”结合图II知,T1>T2,升高温度,B的体积发生增大,则该反应的正反应是放热反应;
A.在t1min时,反应达到平衡状态,正逆反应速率相等,根据A(g)+3B(g)?2C(g),2V正(B)=3V逆(C);
B.其它条件不变,升高温度,正逆反应速率都增大,平衡向吸热反应方向移动;
C.先根据图Ⅰ计算平衡常数,再根据平衡常数计算改变三种物质的浓度达到平衡状态时C的浓度;
D.根据“先拐先平数值大”结合图Ⅱ知,T1>T2,升高温度,平衡向吸热反应方向移动;
解答:
解:A.在t1min时,反应达到平衡状态,正逆反应速率相等,各组分反应速率之比等于计量数之比,根据A(g)+3B(g)?2C(g),2V正(B)=3V逆(C),故A错误;
B.(t1+10)min时,保持压强不变,通入稀有气体,容器体积变大,反应物所占分压减小,平衡向体积增大的方向移动,故B错误;
C.根据图Ⅰ知,化学平衡常数K=
=
,
假设C的平衡浓度是0.4mol/L,
A(g)+3B(g)?2C(g)
开始(mol/L)0.3 0.1 0.4
变化(mol/L)0 0 0
平衡(mol/L)0.3 0.1 0.4
化学平衡常数K′=
=
,所以符合平衡常数K,故C正确;
D.其它条件不变,升高温度,正逆反应速率都增大,平衡向吸热反应方向移动,根据图Ⅱ知,正反应是放热反应,所以平衡向逆反应方向移动,A的转化率降低,故D错误.
故选:C.
B.(t1+10)min时,保持压强不变,通入稀有气体,容器体积变大,反应物所占分压减小,平衡向体积增大的方向移动,故B错误;
C.根据图Ⅰ知,化学平衡常数K=
| 0.42 |
| 0.3×0.13 |
| 1600 |
| 3 |
假设C的平衡浓度是0.4mol/L,
A(g)+3B(g)?2C(g)
开始(mol/L)0.3 0.1 0.4
变化(mol/L)0 0 0
平衡(mol/L)0.3 0.1 0.4
化学平衡常数K′=
| 0.42 |
| 0.3×0.13 |
| 1600 |
| 3 |
D.其它条件不变,升高温度,正逆反应速率都增大,平衡向吸热反应方向移动,根据图Ⅱ知,正反应是放热反应,所以平衡向逆反应方向移动,A的转化率降低,故D错误.
故选:C.
点评:本题考查外界条件对化学平衡移动的影响,正确确定反应方程式是解本题关键,会根据“先拐先平数值大”确定该反应是吸热反应还是放热反应,难度中等.

练习册系列答案
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案
相关题目
一个真空恒容密闭容器中盛有2mol PCl5,加热到200℃发生了反应PCl5(g)?PCl3(g)+Cl2(g),
反应达到平衡时PCl5的分解率为a%.若在同一温度下和同样容器中最初投入的是1mol PCl5,反应达到平衡时PCl5的分解率为b%,a与b的关系是( )
反应达到平衡时PCl5的分解率为a%.若在同一温度下和同样容器中最初投入的是1mol PCl5,反应达到平衡时PCl5的分解率为b%,a与b的关系是( )
| A、a>b | B、a<b |
| C、a=b | D、不能确定 |
已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料.下列说法正确的是( )
| A、工业上利用元素A的单质冶炼金属铁 |
| B、元素C是自然界含量最多的金属元素 |
| C、工业上常用电解法制备元素C、D、E的单质 |
| D、化合物AE与CE有相同类型的化学键 |
一种类似于植物生长调节剂的物质,结构如图所示.下列说法正确的是( )
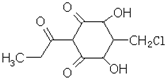

| A、该物质的分子式为:C10H7O5Cl |
| B、1mol该物质在常温下最多可与3mol NaOH反应 |
| C、该物质遇FeCl3溶液不能发生显色反应 |
| D、该物质可发生取代、氧化、消去反应 |
同质量的锌与稀硫酸反应产生氢气,欲使反应速率最大,选择下列组合中的反应条件:①锌粒②锌片③锌粉④98%的浓硫酸⑤15%的稀硫酸⑥20%的稀硫酸⑦加热⑧用冰冷却⑨不断搅拌⑩迅速加入锌片后静置( )
| A、②⑥⑦⑩ | B、①④⑧⑩ |
| C、③⑤⑦⑨ | D、③⑥⑦⑨ |
将0.02mol Na别投入到盛有100mL水、100mL 1mol?L-1盐酸、100mL 1mol?L-1硫酸铜溶液的X、Y、Z三个烧杯中,下列有关说法错误的是( )
| A、三个烧杯中一定均会发生的离子反应有:2Na+2H2O═2Na++2OH-+H2↑ |
| B、三个烧杯中钠均在液面上剧烈反应,相比而言,X烧杯中的反应平缓些 |
| C、Z烧杯中一定会有沉淀生成,但沉淀不是单质铜 |
| D、三个烧杯中生成氢气体的物质的量相同 |
设NA表示阿伏加德罗常数的数值,下列叙述中正确的是( )
| A、常温常压下,48gO3含有的氧原子数为NA个 |
| B、24g金属镁变为镁离子时失去的电子数为NA个 |
| C、在0℃、101kP时,28gN2和CO的混合气体,其体积约为22.4L |
| D、同温同压下,NA个NO与NA个N2和O2的混合气体的体积不相等 |
 出发来合成A,其合成路线如下:
出发来合成A,其合成路线如下: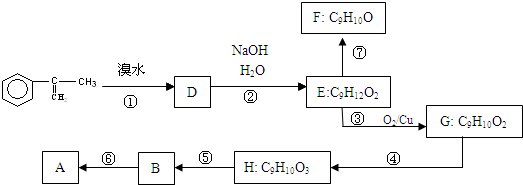
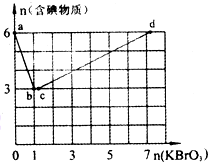 现向含6 mol KI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加人KBrO3的物质的量的关系如图所示.请回答下列问题:
现向含6 mol KI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加人KBrO3的物质的量的关系如图所示.请回答下列问题: