题目内容
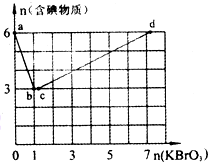 现向含6 mol KI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加人KBrO3的物质的量的关系如图所示.请回答下列问题:
现向含6 mol KI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加人KBrO3的物质的量的关系如图所示.请回答下列问题:(1)b点时,KI反应完全,则氧化产物与还原产物的物质的量之比为
(2)已知b→c过程中,仅有溴元素发生化合价变化,写出并配平该反应的离子方程式
(3)已知在c→d段发生下列反应:2BrO3-+I2=2IO3-+Br2;当n(KBrO3)=3 时,n(I2)=
(4)含a mol KI的硫酸溶液所能消耗n(KBrO3)的最大值为
考点:氧化还原反应的计算
专题:
分析:(1)b点时,KI反应完全,有图象可知参加反应的KI为6mol,KBrO3为1mol,发生反应为6I-+BrO3-=Br-+3I2,氧化产物为碘,还原产物KBr,结合Br元素化合价比较计算注意电子数目;
(2)b→c过程中,仅有一种元素发生化合价变化,应是BrO3-与Br-之间的氧化还原反应;
(3)发生的反应依次有:6I-+6H++BrO3-=Br-+3I2+3H2O,BrO3-+5Br-+6H+=3Br2+3H2O,2BrO3-+I2=2IO3-+Br2,根据方程式计算剩余n(I2)、生成n(Br2);再向溶液中通入足量乙烯,溴与碘与乙烯发生加成反应,可以吸收乙烯,计算吸收乙烯的物质的量,再根据m=nM计算;
(4)发生的反应依次有:6I-+6H++BrO3-=Br-+3I2+3H2O,BrO3-+5Br-+6H+=3Br2+3H2O,2BrO3-+I2=2IO3-+Br2,总反应为5I-+6H++6BrO3-=5IO3-+3Br2+3H2O,据此计算.
(2)b→c过程中,仅有一种元素发生化合价变化,应是BrO3-与Br-之间的氧化还原反应;
(3)发生的反应依次有:6I-+6H++BrO3-=Br-+3I2+3H2O,BrO3-+5Br-+6H+=3Br2+3H2O,2BrO3-+I2=2IO3-+Br2,根据方程式计算剩余n(I2)、生成n(Br2);再向溶液中通入足量乙烯,溴与碘与乙烯发生加成反应,可以吸收乙烯,计算吸收乙烯的物质的量,再根据m=nM计算;
(4)发生的反应依次有:6I-+6H++BrO3-=Br-+3I2+3H2O,BrO3-+5Br-+6H+=3Br2+3H2O,2BrO3-+I2=2IO3-+Br2,总反应为5I-+6H++6BrO3-=5IO3-+3Br2+3H2O,据此计算.
解答:
解:(1)b点时,KI反应完全,有图象可知参加反应的KI为6mol,KBrO3为1mol,发生反应为6I-+BrO3-=Br-+3I2,氧化产物为碘,还原产物KBr,则氧化产物与还原产物的物质的量之比为3:1,反应中Br元素化合价由+5价降低为-1,故转移电子数目为1mol×6×mol-1=6NA,故答案为:3:1;6NA;
(2)b→c过程中,仅有一种元素发生化合价变化,应是BrO3-与Br-之间的氧化还原反应,反应的离子方程式为BrO3-+5Br-+6H+=3Br2+3H2O,故答案为:BrO3-+5Br-+6H+=3Br2+3H2O;
(3)n(KBrO3)=3时,a-b阶段:6I-+BrO3-=Br-+3I2,生成3molI2,1molBr-,消耗1molKBrO3,b-c阶段:BrO3-+5Br-+6H+=3Br2+3H2O,消耗n(BrO3-)=
mol,生成
molBr2,
c-d阶段:2BrO3-+I2=2IO3-+Br2,参加反应n(BrO3-)=(3-1-
)mol=1.8mol,消耗n(I2)=1.8mol×
=0.9mol,生成溴为1.8mol×
=0.9mol,
故余下n(I2)=3mol-0.9mol=2.1mol,
再向溶液中通入足量乙烯,溴与碘与乙烯发生加成反应,可以吸收乙烯为2.1mol+
mol+0.9mol=3.6mol,故充分反应后溶液增加的质量为3.6mol×28g/mol=100.8g,
故答案为:2.1;100.8;
(4)发生的反应依次有6I-+6H++BrO3-=Br-+3I2+3H2O,BrO3-+5Br-+6H+=3Br2+3H2O,2BrO3-+I2=2IO3-+Br2,总反应为5I-+6H++6BrO3-=5IO3-+3Br2+3H2O,则含amolKI的硫酸溶液所能消耗n(KBrO3)的最大值为1.2amol,转移电子为1.2amol×5×mol-1=6NA,
故答案为:1.2a;6NA.
(2)b→c过程中,仅有一种元素发生化合价变化,应是BrO3-与Br-之间的氧化还原反应,反应的离子方程式为BrO3-+5Br-+6H+=3Br2+3H2O,故答案为:BrO3-+5Br-+6H+=3Br2+3H2O;
(3)n(KBrO3)=3时,a-b阶段:6I-+BrO3-=Br-+3I2,生成3molI2,1molBr-,消耗1molKBrO3,b-c阶段:BrO3-+5Br-+6H+=3Br2+3H2O,消耗n(BrO3-)=
| 1 |
| 5 |
| 3 |
| 5 |
c-d阶段:2BrO3-+I2=2IO3-+Br2,参加反应n(BrO3-)=(3-1-
| 1 |
| 5 |
| 1 |
| 2 |
| 1 |
| 2 |
故余下n(I2)=3mol-0.9mol=2.1mol,
再向溶液中通入足量乙烯,溴与碘与乙烯发生加成反应,可以吸收乙烯为2.1mol+
| 3 |
| 5 |
故答案为:2.1;100.8;
(4)发生的反应依次有6I-+6H++BrO3-=Br-+3I2+3H2O,BrO3-+5Br-+6H+=3Br2+3H2O,2BrO3-+I2=2IO3-+Br2,总反应为5I-+6H++6BrO3-=5IO3-+3Br2+3H2O,则含amolKI的硫酸溶液所能消耗n(KBrO3)的最大值为1.2amol,转移电子为1.2amol×5×mol-1=6NA,
故答案为:1.2a;6NA.
点评:本题考查氧化还原反应、化学方程式计算等,题目难度中等,(4)中注意根据关系的关系式计算,也是易错点.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
升高温度对CH3COOH的电离平衡、FeCl3的水解平衡、AgCl的溶解平衡的影响分别是( )
| A、促进、促进、促进 |
| B、抑制、抑制、促进 |
| C、促进、抑制、抑制 |
| D、抑制、促进、抑制 |
T℃时,A气体与B气体反应生成C气体.反应过程中A、B、C浓度变化如图(Ⅰ)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示,则下列结论正确的是( )


| A、在t1min时,3V正(B)=2V逆(C) |
| B、(t1+10)min时,保持容器总压强不变,通入稀有气体,平衡向正反应方向移动 |
| C、T℃时,在相同容器中,若由0.3mol?L-1A、0.1 mol?L-1 B和0.4 mol?L-1 C反应,达到平衡后,C的浓度仍为0.4 mol?L-1 |
| D、其他条件不变,升高温度,正、逆反应速率均增大,且A的转化率增大 |
下列物质是非电解质的是( )
| A、CO2 |
| B、AgCl |
| C、Cu |
| D、氨水 |
学校餐厅内长期使用不锈钢餐具,它也不会生锈的原因是在炼钢的过程中加入了下列物质的( )
| A、铬、锰 | B、铬、硅 |
| C、铬、镍 | D、铬、碳 |
大气污染指( )
| A、大气中含有少量的有毒、有害的物质 |
| B、大气中有毒、有害的物质可以自净到正常值 |
| C、大气中某些有毒、有害物质的含量超过正常值或大气的自净能力 |
| D、空气中氮气的含量大于氧气的含量 |
可以大量共存的离子组是( )
| A、Na+、Fe2+、NO3-、C1- |
| B、K+、HCO3-、SO42-、OH- |
| C、C1O-、C1-、Na+、H- |
| D、Ba2+、K+、SO42-、H+ |
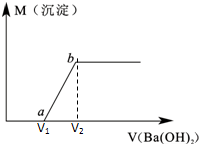 某溶液由盐酸、Na2CO3、H2SO4、CuCl2四种物质中的一种或几种混合形成,现向该混合溶液中滴加Ba(OH)2溶液,产生沉淀的质量与加入Ba(OH)2溶液体积的关系如图所示.
某溶液由盐酸、Na2CO3、H2SO4、CuCl2四种物质中的一种或几种混合形成,现向该混合溶液中滴加Ba(OH)2溶液,产生沉淀的质量与加入Ba(OH)2溶液体积的关系如图所示.