题目内容
17.铁及其化合物在日常生活、生产中应用广泛.研究铁及其化合物的应用意义重大.(1)硫酸亚铁是治疗缺铁性贫血药剂的有效成分.医生建议,服用该药剂的同时服用还原性的维生素C,其原因是防止亚铁被氧化.
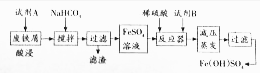
(2)碱式硫酸铁[Fe(OH)SO4]是一种具有多功能的物质,工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
①酸浸过程中,发生非氧化还原反应的离子方程式为Al2O3+6H+=2Al3++3H2O,Fe2O3+6H+=2Fe3++3H2O加入碳酸氢钠的目的是调节溶液的PH,除去铝离子.
②已知常温时Al(OH)3的KAP=3.0×10-34,当pH=4时溶液中c(Al3+)=3×10-4mol•L-1.
③从环保、产品纯度角度分析,试剂B宜选用的物质是c(填编号)
a.NaClO b.KNO3 c.H2O2 d.MnO2 e.KMnO4
(3)高铁电池是一种新型可充电、长时间保持稳定放电的电池,该电池的总反应方程式为3Zn+2K2FeO4+8H2O$?_{充电}^{放电}$2Fe(OH)3+4KOH+3Zn(OH)2,该电池放电时负极附近电解质溶液的pH变小(填“变大”“不变”或“变小”),充电时阳极的电极反应式为Fe(OH)3-3e-+5OH-=FeO42-+4H2O.
分析 (1)维生素C具有还原性,能将三价铁还原为二价铁;
(2)废铁屑中含少量氧化铝、氧化铁等,将过量废铁屑加入稀硫酸中,进行酸浸,所以试剂A为硫酸,发生反应 Fe+H2SO4=FeSO4+H2↑、Al2O3+3H2SO4=Al2(SO4)3+3H2O、Fe2O3+3H2SO4=Fe2(SO4)3+3H2O、Fe2(SO4)3+Fe=3FeSO4,然后在酸浸溶液中再加入NaHCO3并搅拌,调节溶液的pH,发生反应Al3++3HCO3-=Al(OH)3↓+3CO2↑,所以滤渣中成分是Al(OH)3,过滤得到硫酸亚铁,向硫酸亚铁溶液中加入氧化剂,将亚铁离子氧化成铁离子,为了不引入新杂质,可以用H2O2,酸性条件下,H2O2和FeSO4发生氧化还原反应生成铁离子,故B为H2O2,将溶液蒸发浓缩、过滤得到碱式硫酸铁,据此分析解答;
(3)该原电池放电时,Zn失电子作负极,生成锌离子结合溶液中的氢氧根离子生成Zn(OH)2,正极上高铁酸根离子得电子发生还原反应,充电时阳极发生氧化,将Fe(OH)3氧化成K2FeO4,据此书写电极反应式.
解答 解:(1)维生素C具有还原性,能将三价铁还原为二价铁,可以防止亚铁被氧化,
故答案为:防止亚铁被氧化;
(2)废铁屑中含少量氧化铝、氧化铁等,将过量废铁屑加入稀硫酸中,进行酸浸,所以试剂A为硫酸,发生反应 Fe+H2SO4=FeSO4+H2↑、Al2O3+3H2SO4=Al2(SO4)3+3H2O、Fe2O3+3H2SO4=Fe2(SO4)3+3H2O、Fe2(SO4)3+Fe=3FeSO4,然后在酸浸溶液中再加入NaHCO3并搅拌,调节溶液的pH,发生反应Al3++3HCO3-=Al(OH)3↓+3CO2↑,所以滤渣中成分是Al(OH)3,过滤得到硫酸亚铁,向硫酸亚铁溶液中加入氧化剂,将亚铁离子氧化成铁离子,为了不引入新杂质,可以用H2O2,酸性条件下,H2O2和FeSO4发生氧化还原反应生成铁离子,故B为H2O2,将溶液蒸发浓缩、过滤得到碱式硫酸铁,
①根据上面的分析可知,酸浸过程中,发生非氧化还原反应的化学方程式为Al2O3+3H2SO4=Al2(SO4)3+3H2O、Fe2O3+3H2SO4=Fe2(SO4)3+3H2O,对应的离子方程式为 Al2O3+6H+=2Al3++3H2O,Fe2O3+6H+=2Fe3++3H2O,根据上面的分析可知,加入碳酸氢钠的目的是 调节溶液的PH,除去铝离子,
故答案为:Al2O3+6H+=2Al3++3H2O,Fe2O3+6H+=2Fe3++3H2O; 调节溶液的PH,除去铝离子;
②已知常温时Al(OH)3的KsP=3.0×10-34,当pH=4时溶液中c(OH-)=10-10 mol/L,所以c(Al3+)=$\frac{KsP}{{c}^{3}(OH{\;}^{-})}$=$\frac{3.0×10{\;}^{-34}}{({10{\;}^{-10})}^{3}}$=3×10-4mol•L-1,
故答案为:3×10-4;
③根据上面的分析可知,被还原成水,不引入 新的杂质,所以试剂B宜选用H2O2,故选c;
(3)该原电池放电时,Zn失电子作负极,生成锌离子结合溶液中的氢氧根离子生成Zn(OH)2,消耗了氢氧根离子,所以溶液的PH值会变小,正极上高铁酸根离子得电子发生还原反应,充电时阳极发生氧化,将Fe(OH)3氧化成K2FeO4,电极反应式为Fe(OH)3-3e-+5OH-=FeO42-+4H2O,
故答案为:变小;.
点评 本题考查物质的分离和提纯,侧重考查学生获取信息及利用信息能力、分析能力、实验操作能力,注意题给信息的灵活运用,知道常见离子的检验方法及现象,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 用红外光谱来测定有机物分子中不同类型的氢原子和数目 | |
| B. | CH3CH2Br中滴加AgNO3溶液观察是否有浅黄色沉淀,判断卤代烃的类型 | |
| C. | CH3CH2Cl与NaOH的乙醇溶液混合后加热,制得气体通入酸性高锰酸钾溶液中,若溶液褪色,则可检验气体中有乙烯 | |
| D. | 用酸性高锰酸钾溶液区分苯和甲苯 |
| A. | 碳酸氢铵溶液和足量氢氧化钠溶液混合的离子反应:HCO3-+OH-═CO32-+H2O | |
| B. | 等物质的量浓度、等体积的氨水和盐酸混合后:c(NH4+)═c(Cl-) | |
| C. | 0.1 mol•L-1氨水加水稀释,c(NH4+)与c(H+)的比值将减小 | |
| D. | pH=8的0.1 mol•L-lNaX溶液中,由水电离出的c(OH-)=1×10-8mol•L-1 |
| A. | 强酸、强碱都是强电解质 | B. | 可溶性碱都是强电解质 | ||
| C. | 难溶于水的化合物都是弱电解质 | D. | 能导电的物质都是电解质 |
| A. | c(CH3COO-)═c(ClO-) | |
| B. | 溶液物质的量浓度NaClO>CH3COONa | |
| C. | 若将两溶液等体积混合,所得溶液中:c(CH3COO-)+c(ClO-)+c(OH-)═c(Na+)+c(H+) | |
| D. | 等体积的两种溶液分别与0.1mol•L-1的硫酸完全反应,消耗硫酸溶液的体积相等 |

 .
.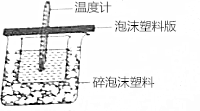 某实验小组设计用0.55mol/L的NaOH溶液50mL与0.50mol/L的盐酸50mL置于如图所示的装置中进行测定中和热的实验.
某实验小组设计用0.55mol/L的NaOH溶液50mL与0.50mol/L的盐酸50mL置于如图所示的装置中进行测定中和热的实验.