题目内容
8.下列关于常温下电解质溶液的叙述中正确的是( )| A. | 碳酸氢铵溶液和足量氢氧化钠溶液混合的离子反应:HCO3-+OH-═CO32-+H2O | |
| B. | 等物质的量浓度、等体积的氨水和盐酸混合后:c(NH4+)═c(Cl-) | |
| C. | 0.1 mol•L-1氨水加水稀释,c(NH4+)与c(H+)的比值将减小 | |
| D. | pH=8的0.1 mol•L-lNaX溶液中,由水电离出的c(OH-)=1×10-8mol•L-1 |
分析 A.碳酸氢铵和足量氢氧化钠溶液反应铵根也会结合氢氧根离子生成一水合氨;
B.等物质的量浓度、等体积的氨水和盐酸混合后恰好反应生成氯化铵溶液,铵根离子水解溶液显酸性,结合电荷守恒分析判断;
C.0.1 mol•L-1氨水加水稀释,促进一水合氨的电离,铵根、氢氧根离子物质的量浓度减小,氢离子物质的量浓度增大;
D.pH=8的0.1 mol•L-lNaX溶液中,X-离子水解结合水电离出的氢离子,促进水电离平衡正向进行,溶液显碱性,氢氧根离子是水完全电离出的离子;
解答 解:A.碳酸氢铵和足量氢氧化钠溶液反应铵根也会结合氢氧根离子生成一水合氨,反应的离子方程式为:NH4++HCO3-+2OH-═CO32-+H2O+NH3•H2O,故A错误;
B.等物质的量浓度、等体积的氨水和盐酸混合后恰好反应生成氯化铵溶液,铵根离子水解溶液显酸性,C(H+)>c(OH-),溶液中电荷守恒分析,C(H+)+c(NH4+)=c(OH-)+c(Cl-),得到c(NH4+)<c(Cl-),故B错误;
C.0.1 mol•L-1氨水加水稀释,促进一水合氨的电离,铵根、氢氧根离子物质的量浓度减小,溶液中离子积常数可知氢离子物质的量难度增大,$\frac{c(N{{H}_{4}}^{+})}{c({H}^{+})}$比值减小,故C正确;
D.pH=8的0.1 mol•L-lNaX溶液中,X-离子水解结合水电离出的氢离子,促进水电离平衡正向进行,溶液显碱性,氢氧根离子是水完全电离出的离子,由水电离出的c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-8}}$=1×10-6mol•L-1,故D错误;
故选C.
点评 本题考查了离子反应、弱电解质电离平衡的影响因素、盐类水解平衡的理解应用,掌握基础是解题关键,题目难度中等.

 通过煤的气化和液化,使碳及其化合物得以广泛应用.
通过煤的气化和液化,使碳及其化合物得以广泛应用.Ⅰ.工业上先用煤转化为CO,再利用CO和水蒸气反应制H2时,存在以下平衡:
CO(g)+H2O(g)?CO2(g)+H2(g)
(1)向1L恒容密闭容器中充入CO和H2O(g),800℃时测得部分数据如下表.
| t/min | 0 | 1 | 2 | 3 | 4 |
| n(H2O)/mol | 0.600 | 0.520 | 0.450 | 0.350 | 0.350 |
| n(CO)/mol | 0.400 | 0.320 | 0.250 | 0.150 | 0.150 |
(2)相同条件下,向2L恒容密闭容器中充入1mol CO、1mol H2O(g)、2mol CO2、2mo1H2,此时v(正)<v(逆)(填“>”“=”或“<”).
Ⅱ.已知CO(g)、H2(g)、CH3OH(l)的燃烧热分别为283kJ•mol-1、286kJ•mol-1、726kJ•mol-1.
(3)利用CO、H2合成液态甲醇的热化学方程式为CO(g)+2H2(g)=CH3OH(l)△H=-129kJ•mol-1.
(4)依据化学反应原理,分析增加压强对制备甲醇反应的影响增加压强使反应速率加快,同时平衡右移,CH3OH产率增大.
Ⅲ.为摆脱对石油的过度依赖,科研人员将煤液化制备汽油,并设计了汽油燃料电池,电池工作原理如图所示:一个电极通入氧气,另一电极通入汽油蒸气,电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-.
(5)以辛烷(C8H18)代表汽油,写出该电池工作时的负极反应方程式C8H18-50e-+25O2-=8CO2+9H2O.
(6)已知一个电子的电量是1.602×10-19C,用该电池电解饱和食盐水,当电路中通过1.929×105C的电量时,生成NaOH80g.
Ⅳ.煤燃烧产生的CO2是造成温室效应的主要气体之一.
(7)将CO2转化成有机物可有效地实现碳循环.如:
a.6CO2+6H2O$\stackrel{光照/叶绿素}{→}$C6H12O6+6O2 b.2CO2+6H2$→_{△}^{催化剂}$C2H5OH+3H2O
c.CO2+CH4$→_{△}^{催化剂}$CH3COOH d.2CO2+6H2$→_{△}^{催化剂}$CH2=CH2+4H2O
以上反应中,最节能的是a,反应b中理论上原子利用率为46%.
| A. | NH3:0.12 mol•L-1 | B. | H2O:0.09 mol•L-1 | ||
| C. | NO:0.03 mol•L-1 | D. | O2:0.15 mol•L-1 |
| A. | NaCl的摩尔质量是58.5 g | |
| B. | 0.5 mol CO2气体中所含的CO2分子数约为3.01×1023 | |
| C. | 标准状况下,6.02×1022个CO2分子所占的体积约是22.4 L | |
| D. | 在1 L水中溶解5.85g NaCl,即可配制得0.1 mol•L-1的NaCl溶液 |
| A. | 已知电离平衡常数:H2CO3>HClO>HCO3-,向NaClO溶液中通入少量CO2的离子方程式:ClO-+CO2+H2O=HClO+HCO3- | |
| B. | 常温下用0.10 mol/L NaOH溶液分别滴定盐酸和醋酸溶液,以HA表示酸,当达到滴定终点时,两溶液中均存在c(Na+)=c(A-) | |
| C. | c(NH4+)相等的(NH4)2SO4溶液、(NH4)2Fe(SO4)2溶液和NH4Cl溶液中,溶质浓度大小关系是:c[(NH4)2SO4]<c[(NH4)2Fe(SO4)2]<c(NH4Cl) | |
| D. | 1 mol冰醋酸和1mol乙醇在浓硫酸、加热条件下充分反应生成的水分子数为NA |
(1)分子中含有的氢原子个数将酸分子分为一元酸、二元酸等
(2)根据反应是否有电子转移将化学反应分为氧化还原反应和非氧化还原反应
(3)根据分散系是否具有丁达尔现象将分散系分为溶液、胶体和浊液
(4)根据反应中的热效应将化学反应分为放热反应和吸热反应
(5)根据氧化物的组成将所有的氧化物分为碱性、两性和酸性氧化物
(6)微粒间相互作用可分为化学键(如离子键、共价键、氢键等)和分子间作用力.
| A. | (1)(3) | B. | (2)(4) | C. | (1)(2)(4)(6) | D. | (2)(3)(4)(5) |

| A. | A物质属于氧化物 | |
| B. | D物质中氯元素的化合价为+1价 | |
| C. | 反应物和生成物均属于化合物 | |
| D. | 反应前后元素的种类和原子个数不变 |
(1)硫酸亚铁是治疗缺铁性贫血药剂的有效成分.医生建议,服用该药剂的同时服用还原性的维生素C,其原因是防止亚铁被氧化.
(2)碱式硫酸铁[Fe(OH)SO4]是一种具有多功能的物质,工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:
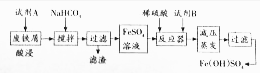
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
①酸浸过程中,发生非氧化还原反应的离子方程式为Al2O3+6H+=2Al3++3H2O,Fe2O3+6H+=2Fe3++3H2O加入碳酸氢钠的目的是调节溶液的PH,除去铝离子.
②已知常温时Al(OH)3的KAP=3.0×10-34,当pH=4时溶液中c(Al3+)=3×10-4mol•L-1.
③从环保、产品纯度角度分析,试剂B宜选用的物质是c(填编号)
a.NaClO b.KNO3 c.H2O2 d.MnO2 e.KMnO4
(3)高铁电池是一种新型可充电、长时间保持稳定放电的电池,该电池的总反应方程式为3Zn+2K2FeO4+8H2O$?_{充电}^{放电}$2Fe(OH)3+4KOH+3Zn(OH)2,该电池放电时负极附近电解质溶液的pH变小(填“变大”“不变”或“变小”),充电时阳极的电极反应式为Fe(OH)3-3e-+5OH-=FeO42-+4H2O.
SiF4(g)+2H2O(g)?SiO2(s)+4HF(g)△H=+148.9kJ•mol-1
下列各项中不能说明该反应已达化学平衡状态的是( )
| A. | v(SiF4)消耗=4v(HF)生成 | B. | HF的体积分数不再变化 | ||
| C. | 容器内气体压强不再变化 | D. | 容器内气体的总质量不再变化 |