��Ŀ����
5��Ԫ�����ڱ���ѧϰ���о���ѧ����Ҫ���ߣ���ͼ��Ԫ�����ڱ���һ���֣�
��1������Ԫ�����ڱ�������������Ϊ5��Ԫ�ط���ΪB��
��2��13��Ԫ�ص�ԭ������ʧȥ�����γ������ӣ����������ӵĽṹʾ��ͼ
 ��
����3����ԭ�ӽṹ����Na��Mgͬ���ڵ�3���ڵ�ԭ��������ԭ�ӵĵ��Ӳ�������3��
��4����6�ź�8��Ԫ���γɵ�һ�ֳ��������ӵķ���ΪCO32-����1��7��8��Ԫ���γɵ�һ�ֳ������ʣ��Σ��Ļ�ѧʽΪNH4NO3��
���� ��1������������Ϊ5��Ԫ��ΪB��
��2��13��Ԫ�ص�ԭ������ʧȥ�����γ������ӣ����Ӻ��������Ϊ10��
��3��Na��Mg�ĵ��Ӳ���ͬ��
��4����6�ź�8��Ԫ���γɵ�һ�ֳ���������Ϊ̼������ӣ���1��7��8��Ԫ���γɵ�һ�ֳ������ʣ��Σ�Ϊ����泥�
��� �⣺��1������Ԫ�����ڱ�������������Ϊ5��Ԫ�ط���ΪB���ʴ�Ϊ��B��
��2��13��Ԫ�ص�ԭ������ʧȥ�����γ������ӣ����Ӻ��������Ϊ10�������ӵĽṹʾ��ͼΪ ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��
��3����ԭ�ӽṹ����Na��Mgͬ���ڵ�3���ڵ�ԭ��������ԭ�ӵĵ��Ӳ�������3���ʴ�Ϊ������ԭ�ӵĵ��Ӳ�������3��
��4����6�ź�8��Ԫ���γɵ�һ�ֳ���������Ϊ̼������ӣ����ӷ���ΪCO32-����1��7��8��Ԫ���γɵ�һ�ֳ������ʣ��Σ�Ϊ����泥���ѧʽΪNH4NO3��
�ʴ�Ϊ��CO32-��NH4NO3��
���� ���⿼��ԭ�ӽṹ��Ԫ�������ɣ�Ϊ��Ƶ���㣬����ԭ�ӽṹ��Ԫ��λ�õĹ�ϵ����ѧ����Ϊ���Ĺؼ������ط�����Ӧ�������Ŀ��飬ע��ԭ�ӽṹ��Ԫ��λ�õĹ�ϵ����Ŀ�ѶȲ���

��ϰ��ϵ�д�
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
�����Ŀ
15����������㾫���ϡ�ʳƷ���Ӽ���ҽҩ��ҵ�����ݡ�ũҩ���л��ϳɵȷ������Ź㷺Ӧ�ã�ijͬѧ�������Ͻ��������ĺϳɲ������䴿�ȣ��ϳ�ԭ�����й��������£�
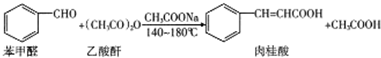
��������ƿ�з���1.5mL��0.015mol����������ı���ȩ��4mL��0.036mol������������������Լ���ϸ��2.2g��ˮ�����ƣ�����2-3����ʯ����ʯ�����ϼ��Ȼ���30min��
����Ӧ����ȴ����10mL��ˮ����Ϊˮ������������δ��ȫ��Ӧ��ı���ȩ���ٽ���ƿ��ȴ������l0mL 10%����������Һ�����ˣ�����Һ����250mL�ձ��У���ȴ�����£�����������Ũ�����ữ����ȴ�����ˣ���������ˮϴ�ӳ�������ɣ��ֲ�Ʒ�ڿ��������ɣ�����Լ1.5g��
��1��ijͬѧ���и�ʵ��ʱ���Ǽӷ�ʯ����ȷ�IJ���Ϊ����Ӧ����ȴ�ӷ�ʯ��
��2��ʯ��������������ʱӦʹ������������ ����������������Ϊ��߷�Ӧ���ת���ʣ�
��3�����˹�����������Ŀ������߱���ȩ��ת���ʣ�
��4������10%NaOH��Һ�������DZ�֤���е������ת��Ϊ���ζ��ܽ⣮
��5����ˮϴ�ӵ�������ϴȥ������л��е�NaCl���ʣ�ͬʱ�����������ܽ�ȼ����ܽ���ʧ���ֲ�Ʒ�Ľ�һ�������ɲ��õķ������ؽᾧ��
��6�������IJ���Ϊ67.6%����������λ��Ч���֣�

| ���� | ������ | ����ܶ� | �۵� | �е� | �ܽ�� |
| ����ȩ | 106 | 1.04 | -26 | 179.62 | ����ˮ���ɻ������Ҵ������ѡ��� |
| ������ | 102 | 1.080 | -73.1 | 138.6 | �������ѣ���ˮ���γ����ᣮ |
| ����� | 148 | 1.247 | 135 | 300 | ����ˮ���������ڱ�����ͪ�����ѡ��Ҵ��� |
����Ӧ����ȴ����10mL��ˮ����Ϊˮ������������δ��ȫ��Ӧ��ı���ȩ���ٽ���ƿ��ȴ������l0mL 10%����������Һ�����ˣ�����Һ����250mL�ձ��У���ȴ�����£�����������Ũ�����ữ����ȴ�����ˣ���������ˮϴ�ӳ�������ɣ��ֲ�Ʒ�ڿ��������ɣ�����Լ1.5g��
��1��ijͬѧ���и�ʵ��ʱ���Ǽӷ�ʯ����ȷ�IJ���Ϊ����Ӧ����ȴ�ӷ�ʯ��
��2��ʯ��������������ʱӦʹ������������ ����������������Ϊ��߷�Ӧ���ת���ʣ�
��3�����˹�����������Ŀ������߱���ȩ��ת���ʣ�
��4������10%NaOH��Һ�������DZ�֤���е������ת��Ϊ���ζ��ܽ⣮
��5����ˮϴ�ӵ�������ϴȥ������л��е�NaCl���ʣ�ͬʱ�����������ܽ�ȼ����ܽ���ʧ���ֲ�Ʒ�Ľ�һ�������ɲ��õķ������ؽᾧ��
��6�������IJ���Ϊ67.6%����������λ��Ч���֣�
16������������ȷ���ǣ�������
| A�� | NaCl��Ħ��������58.5 g | |
| B�� | 0.5 mol CO2������������CO2������ԼΪ3.01��1023 | |
| C�� | ��״���£�6.02��1022��CO2������ռ�����Լ��22.4 L | |
| D�� | ��1 Lˮ���ܽ�5.85g NaCl���������Ƶ�0.1 mol•L-1��NaCl��Һ |
13��������ڻ�ѧѧ�Ƶķ�չ�����˷dz���Ҫ�����ã����з�������������ǣ�������
��1�������к��е���ԭ�Ӹ���������ӷ�ΪһԪ�ᡢ��Ԫ���
��2�����ݷ�Ӧ�Ƿ��е���ת�ƽ���ѧ��Ӧ��Ϊ������ԭ��Ӧ�ͷ�������ԭ��Ӧ
��3�����ݷ�ɢϵ�Ƿ���ж��������ɢϵ��Ϊ��Һ���������Һ
��4�����ݷ�Ӧ�е���ЧӦ����ѧ��Ӧ��Ϊ���ȷ�Ӧ�����ȷ�Ӧ
��5���������������ɽ����е��������Ϊ���ԡ����Ժ�����������
��6����������ÿɷ�Ϊ��ѧ���������Ӽ������ۼ�������ȣ��ͷ��Ӽ���������
��1�������к��е���ԭ�Ӹ���������ӷ�ΪһԪ�ᡢ��Ԫ���
��2�����ݷ�Ӧ�Ƿ��е���ת�ƽ���ѧ��Ӧ��Ϊ������ԭ��Ӧ�ͷ�������ԭ��Ӧ
��3�����ݷ�ɢϵ�Ƿ���ж��������ɢϵ��Ϊ��Һ���������Һ
��4�����ݷ�Ӧ�е���ЧӦ����ѧ��Ӧ��Ϊ���ȷ�Ӧ�����ȷ�Ӧ
��5���������������ɽ����е��������Ϊ���ԡ����Ժ�����������
��6����������ÿɷ�Ϊ��ѧ���������Ӽ������ۼ�������ȣ��ͷ��Ӽ���������
| A�� | ��1����3�� | B�� | ��2����4�� | C�� | ��1����2����4����6�� | D�� | ��2����3����4����5�� |
20����֪���ַ���A��B ��Ӧ�����������ַ���C��D���������жϲ���ȷ���ǣ�������


| A�� | A�������������� | |
| B�� | D��������Ԫ�صĻ��ϼ�Ϊ+1�� | |
| C�� | ��Ӧ�������������ڻ����� | |
| D�� | ��Ӧǰ��Ԫ�ص������ԭ�Ӹ������� |
17�������仯�������ճ����������Ӧ�ù㷺���о������仯�����Ӧ�������ش�
��1����������������ȱ����ƶѪҩ������Ч�ɷ֣�ҽ�����飬���ø�ҩ����ͬʱ���û�ԭ�Ե�ά����C����ԭ���Ƿ�ֹ������������
��2����ʽ������[Fe��OH��SO4]��һ�־��ж�ܵ����ʣ���ҵ�����÷���м�����������������������ȣ�������ʽ�������Ĺ����������£�
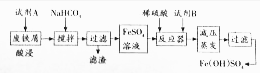
��֪������������������������ʽ����ʱ��Һ��pH���±���
�ش��������⣺
����������У�������������ԭ��Ӧ�����ӷ���ʽΪAl2O3+6H+=2Al3++3H2O��Fe2O3+6H+=2Fe3++3H2O����̼�����Ƶ�Ŀ���ǵ�����Һ��PH����ȥ�����ӣ�
����֪����ʱAl��OH��3��KAP=3.0��10-34����pH=4ʱ��Һ��c��Al3+��=3��10-4mol•L-1��
�۴ӻ�������Ʒ���ȽǶȷ������Լ�B��ѡ�õ�������c�����ţ�
a��NaClO b��KNO3 c��H2O2 d��MnO2 e��KMnO4
��3�����������һ�����Ϳɳ�硢��ʱ�䱣���ȶ��ŵ�ĵ�أ��õ�ص��ܷ�Ӧ����ʽΪ3Zn+2K2FeO4+8H2O$?_{���}^{�ŵ�}$2Fe��OH��3+4KOH+3Zn��OH��2���õ�طŵ�ʱ���������������Һ��pH��С���������䡱��С���������ʱ�����ĵ缫��ӦʽΪFe��OH��3-3e-+5OH-=FeO42-+4H2O��
��1����������������ȱ����ƶѪҩ������Ч�ɷ֣�ҽ�����飬���ø�ҩ����ͬʱ���û�ԭ�Ե�ά����C����ԭ���Ƿ�ֹ������������
��2����ʽ������[Fe��OH��SO4]��һ�־��ж�ܵ����ʣ���ҵ�����÷���м�����������������������ȣ�������ʽ�������Ĺ����������£�

��֪������������������������ʽ����ʱ��Һ��pH���±���
| ������ | Fe��OH��3 | Fe��OH��2 | Al��OH��3 |
| ��ʼ���� | 2.3 | 7.5 | 3.4 |
| ��ȫ���� | 3.2 | 9.7 | 4.4 |
����������У�������������ԭ��Ӧ�����ӷ���ʽΪAl2O3+6H+=2Al3++3H2O��Fe2O3+6H+=2Fe3++3H2O����̼�����Ƶ�Ŀ���ǵ�����Һ��PH����ȥ�����ӣ�
����֪����ʱAl��OH��3��KAP=3.0��10-34����pH=4ʱ��Һ��c��Al3+��=3��10-4mol•L-1��
�۴ӻ�������Ʒ���ȽǶȷ������Լ�B��ѡ�õ�������c�����ţ�
a��NaClO b��KNO3 c��H2O2 d��MnO2 e��KMnO4
��3�����������һ�����Ϳɳ�硢��ʱ�䱣���ȶ��ŵ�ĵ�أ��õ�ص��ܷ�Ӧ����ʽΪ3Zn+2K2FeO4+8H2O$?_{���}^{�ŵ�}$2Fe��OH��3+4KOH+3Zn��OH��2���õ�طŵ�ʱ���������������Һ��pH��С���������䡱��С���������ʱ�����ĵ缫��ӦʽΪFe��OH��3-3e-+5OH-=FeO42-+4H2O��
3��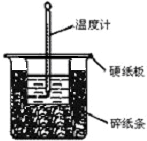 ��50mL0.50mol/L������50mL0.55mol/LNaOH��Һ����ͼ��ʾ��װ���н����кͷ�Ӧ��ͨ���ⶨ��Ӧ���������ų��������ɼ����к��ȣ��ش��������⣺
��50mL0.50mol/L������50mL0.55mol/LNaOH��Һ����ͼ��ʾ��װ���н����кͷ�Ӧ��ͨ���ⶨ��Ӧ���������ų��������ɼ����к��ȣ��ش��������⣺
��1����ʵ��װ���Ͽ���ͼ����ȱ�ٵ�һ�ֲ��������ǻ��β�����������
��2���ձ���������ֽ���������Ǽ���ʵ������е�������ʧ��
��3��Ҫ�ظ���������ʵ���Ŀ���Ǽ���ʵ����
��4�����ձ����粻��Ӳֽ�壬��õ��к�����ֵƫС���ƫ��ƫС����Ӱ�족���������µ���10��ʱ���У���ʵ��������ɽϴ������ԭ������ϵ�ڡ����²�����������ʧ��
��5�������60mL0.50mol/L������50mL0.55mol/LNaOH��Һ���з�Ӧ��������ʵ����ȣ����ų�����������ȣ����ȡ�����ȡ����������к�����ȣ����ȡ�����ȡ���������������Ϊ�к�����ָ�������кͷ�Ӧ����1molH2O���ų��������������������أ�
��6������ͬŨ�Ⱥ�����Ĵ��ᣨCH3COOH������HCl��Һ��������ʵ�飬��õ��к��ȵ���ֵ��ƫС�����ƫ��ƫС����Ӱ�족����
��7������ƽ�в�������õ��������£�
������HCl��NaOH��Һ���ܶȶ�����Ϊ1g/cm3���кͺ����ɵ���Һ�ı�����C=4.18J/��g•�棩����ʵ���õ��к���Ϊ-39.3kJ/mol��
 ��50mL0.50mol/L������50mL0.55mol/LNaOH��Һ����ͼ��ʾ��װ���н����кͷ�Ӧ��ͨ���ⶨ��Ӧ���������ų��������ɼ����к��ȣ��ش��������⣺
��50mL0.50mol/L������50mL0.55mol/LNaOH��Һ����ͼ��ʾ��װ���н����кͷ�Ӧ��ͨ���ⶨ��Ӧ���������ų��������ɼ����к��ȣ��ش��������⣺��1����ʵ��װ���Ͽ���ͼ����ȱ�ٵ�һ�ֲ��������ǻ��β�����������
��2���ձ���������ֽ���������Ǽ���ʵ������е�������ʧ��
��3��Ҫ�ظ���������ʵ���Ŀ���Ǽ���ʵ����
��4�����ձ����粻��Ӳֽ�壬��õ��к�����ֵƫС���ƫ��ƫС����Ӱ�족���������µ���10��ʱ���У���ʵ��������ɽϴ������ԭ������ϵ�ڡ����²�����������ʧ��
��5�������60mL0.50mol/L������50mL0.55mol/LNaOH��Һ���з�Ӧ��������ʵ����ȣ����ų�����������ȣ����ȡ�����ȡ����������к�����ȣ����ȡ�����ȡ���������������Ϊ�к�����ָ�������кͷ�Ӧ����1molH2O���ų��������������������أ�
��6������ͬŨ�Ⱥ�����Ĵ��ᣨCH3COOH������HCl��Һ��������ʵ�飬��õ��к��ȵ���ֵ��ƫС�����ƫ��ƫС����Ӱ�족����
��7������ƽ�в�������õ��������£�
| �¶� ��� | ��ʼ�¶�t1/�� | ��ֹ�¶� T2/�� | �¶Ȳ� ��t/�� | ||
| HCl | NaOH | ƽ��ֵ | |||
| 1 | 25 | 25 | 27.3 | ||
| 2 | 25 | 25 | 27.4 | ||
| 3 | 25 | 25 | 28.6 | ||
 С����Ƶ�̽��ȼ��������ʵ����ͼ��ʾ����ش��������⣮
С����Ƶ�̽��ȼ��������ʵ����ͼ��ʾ����ش��������⣮