题目内容
12.下列说法正确的是( )| A. | 强酸、强碱都是强电解质 | B. | 可溶性碱都是强电解质 | ||
| C. | 难溶于水的化合物都是弱电解质 | D. | 能导电的物质都是电解质 |
分析 A.在溶液中能够完全电离的电解质属于强电解质;
B.溶解度大小与强弱电解质没有必然关系;
C.难溶的化合物不一定为弱电解质,如硫酸钡;
D.能够导电的物质不一定为电解质,如金属单质、硫酸溶液等.
解答 解:A.强酸、强碱在溶液中完全电离,都属于强电解质,故A正确;
B.可溶性碱不一定是强电解质,如一水合氨溶于水,一水合氨属于弱电解质,故B错误;
C.溶解度与强弱电解质没有必然关系,如硫酸钡、碳酸钡难溶于水,但属于强电解质,故C错误;
D.电解质必须为化合物,能够导电的物质不一定为电解质,如金属单质、酸碱盐的混合物,故D错误;
故选A.
点评 本题考查了强弱电解质的判断,题目难度不大,明确电解质与非电解质、强电解质与弱电解质的概念为解答关键,注意溶度积、导电性与强弱电解质之间没有必然关系,试题侧重基础知识的考查,有利于提高学生的灵活应用能力.

练习册系列答案
 步步高达标卷系列答案
步步高达标卷系列答案
相关题目
2.下列物质中属于纯净物的是( )
| A. | 铝热剂 | B. | 生铁 | C. | 不锈钢 | D. | 纯碱 |
3.下列叙述正确的是( )
| A. | 已知电离平衡常数:H2CO3>HClO>HCO3-,向NaClO溶液中通入少量CO2的离子方程式:ClO-+CO2+H2O=HClO+HCO3- | |
| B. | 常温下用0.10 mol/L NaOH溶液分别滴定盐酸和醋酸溶液,以HA表示酸,当达到滴定终点时,两溶液中均存在c(Na+)=c(A-) | |
| C. | c(NH4+)相等的(NH4)2SO4溶液、(NH4)2Fe(SO4)2溶液和NH4Cl溶液中,溶质浓度大小关系是:c[(NH4)2SO4]<c[(NH4)2Fe(SO4)2]<c(NH4Cl) | |
| D. | 1 mol冰醋酸和1mol乙醇在浓硫酸、加热条件下充分反应生成的水分子数为NA |
20.已知两种分子A和B 反应生成另外两种分子C和D,则下列判断不正确的是( )


| A. | A物质属于氧化物 | |
| B. | D物质中氯元素的化合价为+1价 | |
| C. | 反应物和生成物均属于化合物 | |
| D. | 反应前后元素的种类和原子个数不变 |
17.铁及其化合物在日常生活、生产中应用广泛.研究铁及其化合物的应用意义重大.
(1)硫酸亚铁是治疗缺铁性贫血药剂的有效成分.医生建议,服用该药剂的同时服用还原性的维生素C,其原因是防止亚铁被氧化.
(2)碱式硫酸铁[Fe(OH)SO4]是一种具有多功能的物质,工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:
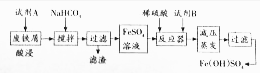
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
回答下列问题:
①酸浸过程中,发生非氧化还原反应的离子方程式为Al2O3+6H+=2Al3++3H2O,Fe2O3+6H+=2Fe3++3H2O加入碳酸氢钠的目的是调节溶液的PH,除去铝离子.
②已知常温时Al(OH)3的KAP=3.0×10-34,当pH=4时溶液中c(Al3+)=3×10-4mol•L-1.
③从环保、产品纯度角度分析,试剂B宜选用的物质是c(填编号)
a.NaClO b.KNO3 c.H2O2 d.MnO2 e.KMnO4
(3)高铁电池是一种新型可充电、长时间保持稳定放电的电池,该电池的总反应方程式为3Zn+2K2FeO4+8H2O$?_{充电}^{放电}$2Fe(OH)3+4KOH+3Zn(OH)2,该电池放电时负极附近电解质溶液的pH变小(填“变大”“不变”或“变小”),充电时阳极的电极反应式为Fe(OH)3-3e-+5OH-=FeO42-+4H2O.
(1)硫酸亚铁是治疗缺铁性贫血药剂的有效成分.医生建议,服用该药剂的同时服用还原性的维生素C,其原因是防止亚铁被氧化.
(2)碱式硫酸铁[Fe(OH)SO4]是一种具有多功能的物质,工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
①酸浸过程中,发生非氧化还原反应的离子方程式为Al2O3+6H+=2Al3++3H2O,Fe2O3+6H+=2Fe3++3H2O加入碳酸氢钠的目的是调节溶液的PH,除去铝离子.
②已知常温时Al(OH)3的KAP=3.0×10-34,当pH=4时溶液中c(Al3+)=3×10-4mol•L-1.
③从环保、产品纯度角度分析,试剂B宜选用的物质是c(填编号)
a.NaClO b.KNO3 c.H2O2 d.MnO2 e.KMnO4
(3)高铁电池是一种新型可充电、长时间保持稳定放电的电池,该电池的总反应方程式为3Zn+2K2FeO4+8H2O$?_{充电}^{放电}$2Fe(OH)3+4KOH+3Zn(OH)2,该电池放电时负极附近电解质溶液的pH变小(填“变大”“不变”或“变小”),充电时阳极的电极反应式为Fe(OH)3-3e-+5OH-=FeO42-+4H2O.
4.下列说法正确的是( )
| A. | 金属钠取用时要用镊子.多余的钠不能放回瓶中 | |
| B. | 用pH试纸检验气体时应预先润湿 | |
| C. | 用苯苹取溴水中的溴时,将溴的苯溶液从分液漏斗下口放出 | |
| D. | 可用新制的银氨溶液鉴别两瓶失去标签的乙醛和葡萄糖溶液 |
10. 图为金的晶胞结构示意图,若金的原子半径为r,则空间利用率的表达式为( )(金的相对原子质量为197)
图为金的晶胞结构示意图,若金的原子半径为r,则空间利用率的表达式为( )(金的相对原子质量为197)
 图为金的晶胞结构示意图,若金的原子半径为r,则空间利用率的表达式为( )(金的相对原子质量为197)
图为金的晶胞结构示意图,若金的原子半径为r,则空间利用率的表达式为( )(金的相对原子质量为197)| A. | $\frac{{\frac{4}{3}π{r^3}×4}}{{{{({\frac{4}{{\sqrt{2}}}r})}^3}}}$×100% | B. | $\frac{{\frac{4}{3}π{r^3}×14}}{{{{({\frac{4}{{\sqrt{2}}}r})}^3}}}$×100% | ||
| C. | $\frac{{\frac{197}{NA}×4}}{{{{({\frac{4}{{\sqrt{2}}}r})}^3}}}$×100% | D. | $\frac{{\frac{4}{3}π{r^3}×8}}{{{{({\frac{8}{{\sqrt{3}}}r})}^3}}}$×100% |
11.把SO2通入NaOH溶液中,当SO2和NaOH完全反应时,其质量比为6:5,则下列说法正确的是( )
| A. | 反应后SO2有剩余 | |
| B. | 溶液还可吸收SO2 | |
| C. | 溶液中除OH-外,只存在一种阴离子 | |
| D. | 溶液中溶质(正盐与酸式盐)的物质的量之比为2:1 |