题目内容
2.(1)质量分数为98%.密度为1.84g/cm3的浓硫酸物质的量浓度是18.4mol/L溶解度为10.86g.(2)配置500mL 1.0mol/L稀H2SO4,则需(1)问中的浓硫酸27.2mL.
分析 (1)根据c=$\frac{1000ρw}{M}$计算该浓硫酸的浓度;令溶液的体积为1000mL,则溶液的质量为18400g,根据$\frac{溶质}{溶液}$=$\frac{溶解度}{100+溶解度}$计算;
(2)根据稀释定律c1V1=c2V2计算需要浓硫酸的体积.
解答 解:(1)质量分数为98%,密度为1.84g/cm3的浓硫酸,其物质的量浓度=$\frac{1000×1.84×98%}{98}$mol/L=18.4mol/L,
令溶液的体积为1000mL,则溶液的质量为18400g,由$\frac{溶质}{溶液}$=$\frac{溶解度}{100+溶解度}$可知,$\frac{18.4mol/L×1L×98g/mol}{18400g}$=$\frac{溶解度}{100+溶解度}$,解得:溶解度=10.86g;
故答案为:18.4mol/L;10.86g;
(2)令需要上述浓硫酸的体积为VmL,根据稀释定律,则:18.4 mol/L×VmL=1 mol/L×500mL,解得V=27.2ml;
故答案为:27.2.
点评 本题考查物质的量浓度有关计算,比较基础,侧重对基础知识的巩固,注意对公式的理解与灵活运用,侧重于考查学生的计算能力.

练习册系列答案
 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案
相关题目
12.X、Y是第三周期的非金属元素,X原子半径比Y原子半径大,则下列叙述中正确的是( )
| A. | X的最高价氧化物对应水化物的酸性比Y的最高价氧化物对应水化物的酸性强 | |
| B. | X原子的得电子能力比Y原子的得电子能力强 | |
| C. | X的阴离子的还原性比Y的阴离子的还原性强 | |
| D. | X的气态氢化物比Y的气态氢化物稳定 |
13.分类方法在化学学科的发展中起到了非常重要的作用,下列分类方法标准合理的是( )
(1)分子中含有的氢原子个数将酸分子分为一元酸、二元酸等
(2)根据反应是否有电子转移将化学反应分为氧化还原反应和非氧化还原反应
(3)根据分散系是否具有丁达尔现象将分散系分为溶液、胶体和浊液
(4)根据反应中的热效应将化学反应分为放热反应和吸热反应
(5)根据氧化物的组成将所有的氧化物分为碱性、两性和酸性氧化物
(6)微粒间相互作用可分为化学键(如离子键、共价键、氢键等)和分子间作用力.
(1)分子中含有的氢原子个数将酸分子分为一元酸、二元酸等
(2)根据反应是否有电子转移将化学反应分为氧化还原反应和非氧化还原反应
(3)根据分散系是否具有丁达尔现象将分散系分为溶液、胶体和浊液
(4)根据反应中的热效应将化学反应分为放热反应和吸热反应
(5)根据氧化物的组成将所有的氧化物分为碱性、两性和酸性氧化物
(6)微粒间相互作用可分为化学键(如离子键、共价键、氢键等)和分子间作用力.
| A. | (1)(3) | B. | (2)(4) | C. | (1)(2)(4)(6) | D. | (2)(3)(4)(5) |
17.铁及其化合物在日常生活、生产中应用广泛.研究铁及其化合物的应用意义重大.
(1)硫酸亚铁是治疗缺铁性贫血药剂的有效成分.医生建议,服用该药剂的同时服用还原性的维生素C,其原因是防止亚铁被氧化.
(2)碱式硫酸铁[Fe(OH)SO4]是一种具有多功能的物质,工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:
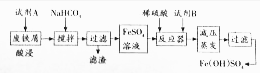
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
回答下列问题:
①酸浸过程中,发生非氧化还原反应的离子方程式为Al2O3+6H+=2Al3++3H2O,Fe2O3+6H+=2Fe3++3H2O加入碳酸氢钠的目的是调节溶液的PH,除去铝离子.
②已知常温时Al(OH)3的KAP=3.0×10-34,当pH=4时溶液中c(Al3+)=3×10-4mol•L-1.
③从环保、产品纯度角度分析,试剂B宜选用的物质是c(填编号)
a.NaClO b.KNO3 c.H2O2 d.MnO2 e.KMnO4
(3)高铁电池是一种新型可充电、长时间保持稳定放电的电池,该电池的总反应方程式为3Zn+2K2FeO4+8H2O$?_{充电}^{放电}$2Fe(OH)3+4KOH+3Zn(OH)2,该电池放电时负极附近电解质溶液的pH变小(填“变大”“不变”或“变小”),充电时阳极的电极反应式为Fe(OH)3-3e-+5OH-=FeO42-+4H2O.
(1)硫酸亚铁是治疗缺铁性贫血药剂的有效成分.医生建议,服用该药剂的同时服用还原性的维生素C,其原因是防止亚铁被氧化.
(2)碱式硫酸铁[Fe(OH)SO4]是一种具有多功能的物质,工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
①酸浸过程中,发生非氧化还原反应的离子方程式为Al2O3+6H+=2Al3++3H2O,Fe2O3+6H+=2Fe3++3H2O加入碳酸氢钠的目的是调节溶液的PH,除去铝离子.
②已知常温时Al(OH)3的KAP=3.0×10-34,当pH=4时溶液中c(Al3+)=3×10-4mol•L-1.
③从环保、产品纯度角度分析,试剂B宜选用的物质是c(填编号)
a.NaClO b.KNO3 c.H2O2 d.MnO2 e.KMnO4
(3)高铁电池是一种新型可充电、长时间保持稳定放电的电池,该电池的总反应方程式为3Zn+2K2FeO4+8H2O$?_{充电}^{放电}$2Fe(OH)3+4KOH+3Zn(OH)2,该电池放电时负极附近电解质溶液的pH变小(填“变大”“不变”或“变小”),充电时阳极的电极反应式为Fe(OH)3-3e-+5OH-=FeO42-+4H2O.
7.下列物质在溶液中电离出的Cl-与1mol CaCl2电离出的Cl-数目相同的是( )
| A. | 2mol KClO3 | B. | 1mol KCl | C. | 1mol Ca(ClO)2 | D. | 2mol NaCl |
3.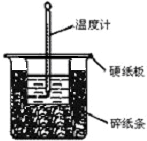 用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是环形玻璃搅拌器.
(2)烧杯间填满碎纸条的作用是减少实验过程中的热量损失.
(3)要重复进行三次实验的目的是减少实验误差.
(4)大烧杯上如不盖硬纸板,求得的中和热数值偏小(填“偏大、偏小、无影响”);当室温低于10℃时进行,对实验结果会造成较大的误差,其原因是体系内、外温差大,会造成热量损失.
(5)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量不相等(填“相等、不相等”),所求中和热相等(填“相等、不相等”),简述理由因为中和热是指酸跟碱发生中和反应生成1molH2O所放出的热量,与酸碱的用量无关.
(6)用相同浓度和体积的醋酸(CH3COOH)代替HCl溶液进行上述实验,测得的中和热的数值会偏小;(填“偏大、偏小、无影响”).
(7)三次平行操作所测得的数据如下:
若上述HCl、NaOH溶液的密度都近似为1g/cm3,中和后生成的溶液的比热容C=4.18J/(g•℃),则实验测得的中和热为-39.3kJ/mol.
 用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:(1)从实验装置上看,图中尚缺少的一种玻璃仪器是环形玻璃搅拌器.
(2)烧杯间填满碎纸条的作用是减少实验过程中的热量损失.
(3)要重复进行三次实验的目的是减少实验误差.
(4)大烧杯上如不盖硬纸板,求得的中和热数值偏小(填“偏大、偏小、无影响”);当室温低于10℃时进行,对实验结果会造成较大的误差,其原因是体系内、外温差大,会造成热量损失.
(5)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量不相等(填“相等、不相等”),所求中和热相等(填“相等、不相等”),简述理由因为中和热是指酸跟碱发生中和反应生成1molH2O所放出的热量,与酸碱的用量无关.
(6)用相同浓度和体积的醋酸(CH3COOH)代替HCl溶液进行上述实验,测得的中和热的数值会偏小;(填“偏大、偏小、无影响”).
(7)三次平行操作所测得的数据如下:
| 温度 序号 | 起始温度t1/℃ | 终止温度 T2/℃ | 温度差 △t/℃ | ||
| HCl | NaOH | 平均值 | |||
| 1 | 25 | 25 | 27.3 | ||
| 2 | 25 | 25 | 27.4 | ||
| 3 | 25 | 25 | 28.6 | ||
20.下列物质不能使酸性高锰酸钾溶液褪色的是( )
| A. | 乙烯 | B. | 乙醇 | C. | 苯 | D. | 二氧化硫 |
 小明设计的探究燃烧条件的实验如图所示.请回答下列问题.
小明设计的探究燃烧条件的实验如图所示.请回答下列问题.