题目内容
10.已知RxO42-+MnO4-+H+-RO2+Mn2++H2O的变化过程中,有0.2m olRxO42-离子参加反应时,共转移0.4mol电子.(1)反应的氧化产物为RO2; (2)x=2;(3)写出配平的离子方程式5R2O42-+2MnO4-+16H+=10RO2+2Mn2++8H2O.
分析 反应中Mn元素的化合价降低,则R元素的化合价升高,0.2m olRxO42-离子参加反应时,共转移0.4mol电子,则0.2mol×2×(4-$\frac{6}{x}$)=0.4,结合电子、电荷守恒解答.
解答 解:(1)Mn元素的化合价降低,则R失去电子被氧化,对应氧化产物为RO2,故答案为:RO2;
(2)0.2m olRxO42-离子参加反应时,共转移0.4mol电子,则0.2mol×2×(4-$\frac{6}{x}$)=0.4,解得x=2,故答案为:2;
(3)由电子、电荷守恒可知,离子反应为5R2O42-+2MnO4-+16H+=10RO2+2Mn2++8H2O,故答案为:5R2O42-+2MnO4-+16H+=10RO2+2Mn2++8H2O.
点评 本题考查氧化还原反应及计算,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意电子、电荷守恒的应用,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案
相关题目
20.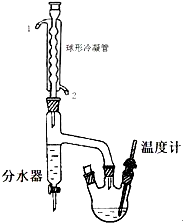 正丁醚是惰性溶剂,可用作有机合成反应溶剂.某实验小组利用如下装置(夹持和加热装置均省略)合成正丁醚.发生的反应为:
正丁醚是惰性溶剂,可用作有机合成反应溶剂.某实验小组利用如下装置(夹持和加热装置均省略)合成正丁醚.发生的反应为:
2CH3CH2CH2CH2OH $\stackrel{H_{2}SO_{4}}{→}$ CH3CH2CH2CH2OCH2CH2CH2CH3+H2O
反应物和产物的相关数据列表如下:
实验步骤:
在一定容积的三口烧瓶中,加入10.9g(相当13.5mL)正丁醇、2.5mL浓硫酸和几粒沸石,摇匀后,一口装上温度计,温度计插入液面以下,另一口装上分水器,分水器的上端接球形冷凝管,先在分水器内放置1.7mL水,另一口用塞子塞紧.然后将三口瓶放在石棉网上小火加热至微沸,进行分水.反应中产生的水经球形冷凝管后,收集在分水器的下层,上层有机层积至分水器支管时,即可返回烧瓶.大约经1.5h后,三口瓶中反应液温度可达134一136℃,当下层水至分水器的支管口处停止反应.
将反应液冷却到室温后倒入盛有25mL水的分液漏斗中,经过分离、洗涤后再分离提纯可得正丁醚3.4g.回答下列问题:
(1)该实验时球形冷凝管的进水口为2(填1或2);
(2)本实验中容易产生烃类化合物的化学反应方程式为:CH3CH2CH2CH2OH$→_{△}^{浓硫酸}$C2H5CH=CH2+H2O.
(3)反应液冷却到室温后倒入盛有25mL水的分液漏斗中,振荡静置,得到有机层的操作方法是将分液漏斗颈上的玻璃塞打开,在将分液漏斗下面活塞拧开,使下层液体慢慢沿烧杯壁流下,关闭分液漏斗,将上层有机物从分液漏斗上口倒出.
(4)有机层粗产物依次用12mL水、8mL 5%氢氧化钠溶液、8mL水和8mL饱和氯化钙溶液洗涤.用氢氧化钠溶液洗涤的目的是除去产品中的硫酸.
(5)洗涤完成后,通过以下操作分离、提纯产物,正确的操作顺序是cba(填字母).
a.蒸馏 b.过滤 c.加入无水CaCl2
(6)本实验所得到的正丁醚产率为35.34%.
 正丁醚是惰性溶剂,可用作有机合成反应溶剂.某实验小组利用如下装置(夹持和加热装置均省略)合成正丁醚.发生的反应为:
正丁醚是惰性溶剂,可用作有机合成反应溶剂.某实验小组利用如下装置(夹持和加热装置均省略)合成正丁醚.发生的反应为:2CH3CH2CH2CH2OH $\stackrel{H_{2}SO_{4}}{→}$ CH3CH2CH2CH2OCH2CH2CH2CH3+H2O
反应物和产物的相关数据列表如下:
| 化合物名称 | 密度(g/mL) | 熔点(℃) | 沸点(℃) | 水中溶解性 |
| 正丁醇 | 0.810 | -89.8 | 118.0 | 微溶 |
| 正丁醚 | 0.7689 | -95.3 | 142 | 不溶于水 |
| 备注:正丁醚微溶于饱和氯化钙溶液. | ||||
在一定容积的三口烧瓶中,加入10.9g(相当13.5mL)正丁醇、2.5mL浓硫酸和几粒沸石,摇匀后,一口装上温度计,温度计插入液面以下,另一口装上分水器,分水器的上端接球形冷凝管,先在分水器内放置1.7mL水,另一口用塞子塞紧.然后将三口瓶放在石棉网上小火加热至微沸,进行分水.反应中产生的水经球形冷凝管后,收集在分水器的下层,上层有机层积至分水器支管时,即可返回烧瓶.大约经1.5h后,三口瓶中反应液温度可达134一136℃,当下层水至分水器的支管口处停止反应.
将反应液冷却到室温后倒入盛有25mL水的分液漏斗中,经过分离、洗涤后再分离提纯可得正丁醚3.4g.回答下列问题:
(1)该实验时球形冷凝管的进水口为2(填1或2);
(2)本实验中容易产生烃类化合物的化学反应方程式为:CH3CH2CH2CH2OH$→_{△}^{浓硫酸}$C2H5CH=CH2+H2O.
(3)反应液冷却到室温后倒入盛有25mL水的分液漏斗中,振荡静置,得到有机层的操作方法是将分液漏斗颈上的玻璃塞打开,在将分液漏斗下面活塞拧开,使下层液体慢慢沿烧杯壁流下,关闭分液漏斗,将上层有机物从分液漏斗上口倒出.
(4)有机层粗产物依次用12mL水、8mL 5%氢氧化钠溶液、8mL水和8mL饱和氯化钙溶液洗涤.用氢氧化钠溶液洗涤的目的是除去产品中的硫酸.
(5)洗涤完成后,通过以下操作分离、提纯产物,正确的操作顺序是cba(填字母).
a.蒸馏 b.过滤 c.加入无水CaCl2
(6)本实验所得到的正丁醚产率为35.34%.
1.化学与环境、科学、技术密切相关.下列有关说法中正确的是( )
| A. | 可使用填埋法处理未经分类的生活垃圾 | |
| B. | 光化学烟雾的形成与汽车尾气中的氮氧化物有关 | |
| C. | 光导纤维都是有机高分子化合物 | |
| D. | “鸟巢”使用钒氮合金钢,该合金熔点、硬度和强度均比纯铁高 |
18.某反应的反应过程中能量变化如图所示.下列有关叙述正确的是( )


| A. | 该反应为放热反应 | |
| B. | 催化剂能降低该反应的焓变 | |
| C. | 催化剂能降低E2的值 | |
| D. | 逆反应的活化能大于正反应的活化能 |
5.在1L某一元弱酸HR的溶液中,H+与HR的个数之比为m:n,则此时HR的电离平衡常数为( )
| A. | $\frac{{m}^{2}}{n}$ | B. | $\frac{{m}^{2}}{m+n}$ | C. | $\frac{{m}^{2}}{n-m}$ | D. | $\frac{{n}^{2}}{{m}^{3}}$ |
15.往20ml 1mol/L的AlCl3溶液中滴加0.2mol/L的NaOH溶液,最后有1.17克沉淀生成,则加入NaOH溶液的体积是( )
| A. | 125 mL | B. | 275 mL | C. | 325 mL | D. | 450 mL |
2.下列说法正确的是( )
| A. | 萃取溴水中的溴,将四氯化碳和溴水混合后,振荡并打开分液漏斗瓶塞,使漏斗内气体放出 | |
| B. | 在蔗糖中加入浓硫酸时,蔗糖变黑,证明浓硫酸具有脱水性 | |
| C. | 向Ba(NO3)2溶液中通入SO2气体,产生白色沉淀,可推测SO2与可溶性钡盐均能反应产生白色沉淀 | |
| D. | 若要检验铜和浓硫酸反应后产物硫酸铜,可向反应后的试管中加入少量水,观察溶液是否变蓝,若变蓝则证明有硫酸铜生成 |
19.将固体NH4I置于密闭容器中,在一定温度下发生下列反应:①NH4I(s)?NH3(g)+HI(g) ②2HI(g)?H2(g)+I2(g).达到平衡时,c(H2)=1mol•L-1,c(HI)=4mol•L-1,则此温度下反应①的平衡常数为( )
| A. | 22 | B. | 24 | C. | 20 | D. | 25 |
7.某研究性学习小组欲探究影响锌和稀硫酸反应速率的外界条件,下表是其实验设计的有关数据:
(1)在此5组实验中,其速率最快的实验是5(填实验序号).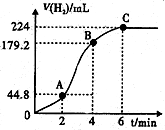
(2)对锌和稀硫酸反应,实验2和4表明,硫酸的浓度对反应速率有影响;实验1和3表明,是否形成原电池对反应速率有影响.
(3)进行实验2时,小组同学根据实验过程绘制的标准状况下的气体体积V与时间t的图象如图所示.
①在OA、AB、BC三段中反应速率最快的是AB,原因是反应放热,使温度升高,反应速率加快.
②2~4min内以硫酸的浓度变化表示的反应速率(假设溶液的体积不变)为0.06mol•L-1•min-1.
| 实验 序号 | 锌的质量/g | 锌的 状态 | c(H2SO4)/mol•L-1 | V(H2SO4)/mL | 反应前溶液的温度/℃ | 添加剂 |
| 1 | 0.65 | 粉状 | 0.5 | 50 | 20 | 无 |
| 2 | 0.65 | 粉末 | 0.5 | 50 | 20 | 无 |
| 3 | 0.65 | 粉状 | 0.5 | 50 | 20 | 2滴CuSO4溶液 |
| 4 | 0.65 | 粉末 | 0.8 | 50 | 20 | 无 |
| 5 | 0.65 | 粉末 | 0.8 | 50 | 35 | 2滴CuSO4溶液 |

(2)对锌和稀硫酸反应,实验2和4表明,硫酸的浓度对反应速率有影响;实验1和3表明,是否形成原电池对反应速率有影响.
(3)进行实验2时,小组同学根据实验过程绘制的标准状况下的气体体积V与时间t的图象如图所示.
①在OA、AB、BC三段中反应速率最快的是AB,原因是反应放热,使温度升高,反应速率加快.
②2~4min内以硫酸的浓度变化表示的反应速率(假设溶液的体积不变)为0.06mol•L-1•min-1.