题目内容
5.在1L某一元弱酸HR的溶液中,H+与HR的个数之比为m:n,则此时HR的电离平衡常数为( )| A. | $\frac{{m}^{2}}{n}$ | B. | $\frac{{m}^{2}}{m+n}$ | C. | $\frac{{m}^{2}}{n-m}$ | D. | $\frac{{n}^{2}}{{m}^{3}}$ |
分析 根据弱电解质的电离平衡方程式,利用H+与HR的之间的关系,结合电离平衡常数来计算.
解答 解:H+与HR的个数之比为m:n,所以物质的量浓度之比为m:n,
设H+的浓度为n,则HR的浓度为m,则
HR=H++R-,
n m m
所以K=$\frac{m×m}{n}$=$\frac{{m}^{2}}{n}$,故选A.
点评 本题主要考查弱酸的电离方程式的含义、溶液中氢离子浓度和电离平衡常数的关系,是一道基础题目,难度不大.

练习册系列答案
相关题目
15.物质灼烧时,火焰呈紫色的一定含有( )
| A. | 钾原子 | B. | 钾离子 | C. | 钾元素 | D. | 钾的化合物 |
16.在相同温度下等体积、等物质的量浓度的4种稀溶液:①Na2SO4 ②H2SO3 ③NaHSO3④Na2S,所含带电微粒的数目由多到少的顺序是( )
| A. | ①=④>③=② | B. | ①=④>③>② | C. | ①>④>③>② | D. | ④>①>③>② |
13.离子方程式正确的是( )
| A. | 铁跟盐酸的反应 Fe+2H+═Fe3++H2↑ | |
| B. | 氯化铵固体和熟石灰共热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| C. | 向碳酸钙中加入盐酸 CO32-+2H+═H2O+CO2↑ | |
| D. | 氯化铁溶液和氢氧化钠溶液的反应 Fe3++3OH-═Fe(OH)3↓ |
20.下列反应在任何温度下均能自发进行的是( )
| A. | 2N2(g)+O2(g)═2N2O(g)△H=+163 kJ•mol-1 | |
| B. | Fe(s)+$\frac{3}{2}$Cl2(g)═FeCl3(s)△H=-138 kJ•mol-1 | |
| C. | 2HgO(s)═2Hg(l)+O2(g)△H=+182 kJ•mol-1 | |
| D. | H2O2(l)═$\frac{1}{2}$O2(g)+H2O(l)△H=-98 kJ•mol-1 |
17.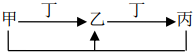 甲、乙、丙、丁四种物质中,甲、乙、丙含有相同的某种元素,它们之间有如下转化关系,则下列有关物质的推断错误的是( )
甲、乙、丙、丁四种物质中,甲、乙、丙含有相同的某种元素,它们之间有如下转化关系,则下列有关物质的推断错误的是( )
 甲、乙、丙、丁四种物质中,甲、乙、丙含有相同的某种元素,它们之间有如下转化关系,则下列有关物质的推断错误的是( )
甲、乙、丙、丁四种物质中,甲、乙、丙含有相同的某种元素,它们之间有如下转化关系,则下列有关物质的推断错误的是( )| A. | 若甲为焦炭,则丁可能是O2 | |
| B. | 若甲为NaOH溶液,则丁可能是CO2 | |
| C. | 若甲为铝盐溶液,则丁可能是NaOH溶液 | |
| D. | 若甲为Fe,则丁可能是氯气 |
14.在2A(g)+B(g)?3C(g)+5D(g)反应中,表示该反应速率最快的是( )
| A. | v(A)=0.5 mol/(L•s) | B. | v(B)=0.3 mol/(L•s) | C. | v(C)=0.8 mol/(L•s) | D. | v(D)=0.4 mol/(L•s) |
2.NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 1mol•L-1NaHCO3溶液中,Na+数目为NA | |
| B. | 2.4gMg与足量盐酸完全反应时,失去电子数目为0.1NA | |
| C. | 等物质的量的N2和CO所含分子数、原子个数、电子总数均相同 | |
| D. | 标准状况下,11.2L的水中含有0.5个NA水分子 |