题目内容
20.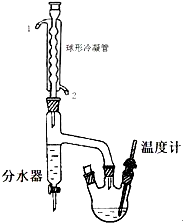 正丁醚是惰性溶剂,可用作有机合成反应溶剂.某实验小组利用如下装置(夹持和加热装置均省略)合成正丁醚.发生的反应为:
正丁醚是惰性溶剂,可用作有机合成反应溶剂.某实验小组利用如下装置(夹持和加热装置均省略)合成正丁醚.发生的反应为:2CH3CH2CH2CH2OH $\stackrel{H_{2}SO_{4}}{→}$ CH3CH2CH2CH2OCH2CH2CH2CH3+H2O
反应物和产物的相关数据列表如下:
| 化合物名称 | 密度(g/mL) | 熔点(℃) | 沸点(℃) | 水中溶解性 |
| 正丁醇 | 0.810 | -89.8 | 118.0 | 微溶 |
| 正丁醚 | 0.7689 | -95.3 | 142 | 不溶于水 |
| 备注:正丁醚微溶于饱和氯化钙溶液. | ||||
在一定容积的三口烧瓶中,加入10.9g(相当13.5mL)正丁醇、2.5mL浓硫酸和几粒沸石,摇匀后,一口装上温度计,温度计插入液面以下,另一口装上分水器,分水器的上端接球形冷凝管,先在分水器内放置1.7mL水,另一口用塞子塞紧.然后将三口瓶放在石棉网上小火加热至微沸,进行分水.反应中产生的水经球形冷凝管后,收集在分水器的下层,上层有机层积至分水器支管时,即可返回烧瓶.大约经1.5h后,三口瓶中反应液温度可达134一136℃,当下层水至分水器的支管口处停止反应.
将反应液冷却到室温后倒入盛有25mL水的分液漏斗中,经过分离、洗涤后再分离提纯可得正丁醚3.4g.回答下列问题:
(1)该实验时球形冷凝管的进水口为2(填1或2);
(2)本实验中容易产生烃类化合物的化学反应方程式为:CH3CH2CH2CH2OH$→_{△}^{浓硫酸}$C2H5CH=CH2+H2O.
(3)反应液冷却到室温后倒入盛有25mL水的分液漏斗中,振荡静置,得到有机层的操作方法是将分液漏斗颈上的玻璃塞打开,在将分液漏斗下面活塞拧开,使下层液体慢慢沿烧杯壁流下,关闭分液漏斗,将上层有机物从分液漏斗上口倒出.
(4)有机层粗产物依次用12mL水、8mL 5%氢氧化钠溶液、8mL水和8mL饱和氯化钙溶液洗涤.用氢氧化钠溶液洗涤的目的是除去产品中的硫酸.
(5)洗涤完成后,通过以下操作分离、提纯产物,正确的操作顺序是cba(填字母).
a.蒸馏 b.过滤 c.加入无水CaCl2
(6)本实验所得到的正丁醚产率为35.34%.
分析 (1)根据逆流时冷凝效果好判断进水口;
(2)正丁醇在浓硫酸加热的条件下容易脱水生成1-丁烯;
(3)反应液冷却到室温后倒入盛有25mL水的分液漏斗中,振荡静置,由于正丁醚的密度小于水,所以得到有机层在上层,要先将水层从分液漏斗下口放出,再将上层液体从上口倒出;
(4)有机层粗产物中有少量的硫酸,可以用氢氧化钠除去;
(5)洗涤完成后,加入无水氯化钙干燥,通过过滤除去无水氯化钙,再通过蒸馏可得丁醚;
(6)10.9g(相当13.5mL)正丁醇的物质的量为0.147mol,根据反应2CH3CH2CH2CH2OH $\stackrel{H_{2}SO_{4}}{→}$ CH3CH2CH2CH2OCH2CH2CH2CH3+H2O,生成的丁醚的物质的量为0.074mol,计算出理论产量,正丁醚产率=$\frac{实际产量}{理论产量}$×100%;
解答 解::(1)根据逆流时冷凝效果好,所以进水口为2,
故答案为:2;
(2)正丁醇在浓硫酸加热的条件下容易脱水生成1-丁烯,反应方程式CH3CH2CH2CH2OH $→_{△}^{浓硫酸}$C2H5CH=CH2+H2O,
故答案为:CH3CH2CH2CH2OH $→_{△}^{浓硫酸}$C2H5CH=CH2+H2O;
(3)反应液冷却到室温后倒入盛有25mL水的分液漏斗中,振荡静置,由于正丁醚的密度小于水,所以得到有机层在上层,要先将水层从分液漏斗下口放出,再将上层液体从上口倒出,操作为将分液漏斗颈上的玻璃塞打开,再将分液漏斗下面活塞拧开,使下层液体慢慢沿烧杯壁留下,关闭分液漏斗,将上层有机物从分液漏斗上口倒出,
故答案为:将分液漏斗颈上的玻璃塞打开,再将分液漏斗下面活塞拧开,使下层液体慢慢沿烧杯壁留下,关闭分液漏斗,将上层有机物从分液漏斗上口倒出;
(4)有机层粗产物中有少量的硫酸,可以用氢氧化钠除去产品中的硫酸,
故答案为:除去产品中的硫酸;
(5)洗涤完成后,过滤除去无水氯化钙,再通过蒸馏可得丁醚,所以操作顺序是cba,
故答案为:cba;
(6)10.9g(相当13.5mL)正丁醇的物质的量为0.147mol,根据反应2CH3CH2CH2CH2OH$→_{△}^{浓硫酸}$C4H9OC4H9+H2O,生成的丁醚的物质的量为0.074mol,丁醚的理论产量为130×0.074g=9.62g,所以正丁醚产率=$\frac{实际产量}{理论产量}$×100%=$\frac{3.4g}{9.62g}$×100%=35.34%,
故答案为:35.34%.
点评 本题考查实验的基本操作,为高频考点,涉及混合物的分离和提纯及物质制备、有关物质的量基本计算和产率的计算等,侧重考查学生综合应用能力及实验操作能力,题目难度中等.

| A. | 液氨用作制冷剂 | B. | 四氯化碳萃取碘水中的碘 | ||
| C. | 铁和铝遇到浓硝酸钝化 | D. | 蒸馏法将海水淡化为饮用水 |
| A. | 钾原子 | B. | 钾离子 | C. | 钾元素 | D. | 钾的化合物 |
| A. | 标准状况下,22.4LCH2Cl2中含有C-Cl键数目为0.2NA | |
| B. | 常温常压下,3.0g尿素与乙酸的混合物,含氢原子总数为0.2NA | |
| C. | 常温常压下,10g92%酒精水溶液含氧原子总数为0.2NA | |
| D. | 常温常压下,0.1molNa2O2与水完全反应转移电子数为0.2NA |
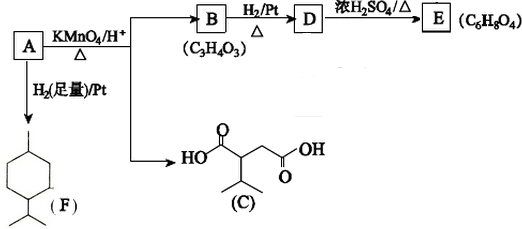
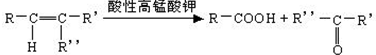
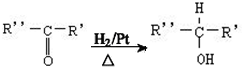
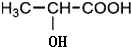 $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$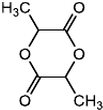 +2H2O.
+2H2O. ,A与等物质的量的Br2进行加成反应的产物共有3种(不考虑立体异构).
,A与等物质的量的Br2进行加成反应的产物共有3种(不考虑立体异构).