题目内容
7.某研究性学习小组欲探究影响锌和稀硫酸反应速率的外界条件,下表是其实验设计的有关数据:| 实验 序号 | 锌的质量/g | 锌的 状态 | c(H2SO4)/mol•L-1 | V(H2SO4)/mL | 反应前溶液的温度/℃ | 添加剂 |
| 1 | 0.65 | 粉状 | 0.5 | 50 | 20 | 无 |
| 2 | 0.65 | 粉末 | 0.5 | 50 | 20 | 无 |
| 3 | 0.65 | 粉状 | 0.5 | 50 | 20 | 2滴CuSO4溶液 |
| 4 | 0.65 | 粉末 | 0.8 | 50 | 20 | 无 |
| 5 | 0.65 | 粉末 | 0.8 | 50 | 35 | 2滴CuSO4溶液 |
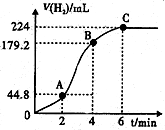
(2)对锌和稀硫酸反应,实验2和4表明,硫酸的浓度对反应速率有影响;实验1和3表明,是否形成原电池对反应速率有影响.
(3)进行实验2时,小组同学根据实验过程绘制的标准状况下的气体体积V与时间t的图象如图所示.
①在OA、AB、BC三段中反应速率最快的是AB,原因是反应放热,使温度升高,反应速率加快.
②2~4min内以硫酸的浓度变化表示的反应速率(假设溶液的体积不变)为0.06mol•L-1•min-1.
分析 影响锌与稀硫酸的反应速率的因素,除锌粉的颗粒大小、质量及纯度外,主要是浓度、温度及催化剂等因素;
(1)对相同的锌粉来说,稀硫酸的浓度越大,反应速率越快,温度越高反应速率越快,利用原电池原理也可以加快反应速率;
(2)2和4除浓度不等,其它因素均相同;3比1多滴加了2滴CuSO4溶液;
(3)①分析相同时间内氢气体积的多少来判断速率的快慢;
②利用速率表达式v=△c/△t计算速率.
解答 解:(1)第5组实验时温度最高,浓度最大,也滴加了硫酸铜溶液,利用了Zn-Cu原电池,因此反应速率最快,故答案为:5;
(2)实验2和4除浓度不同外,其余均相同,应该是考查硫酸的浓度对速率的影响,实验3比1多了形成Zn-Cu原电池,因此考查影响速率的因素是否形成原电池,故答案为:硫酸的浓度;是否形成原电池;
(3)①从图中看出2-4分钟内产生氢气最多,故这段时间内反应速率最大,因为为反应放热,使温度升高,反应速率加快,故答案为:AB;反应放热,使温度升高,反应速率加快;
②2-4分钟内,产生氢气179.2-44.8=134.4mL,物质的量为$\frac{134.4×1{0}^{-3}L}{22.4L/mol}$=6×10-3mol,根据反应方程式:Zn+H2SO4=ZnSO4+H2↑可知,参加反应硫酸的物质的量为:6×10-3mol,v(H2SO4)=$\frac{△c}{△t}$=$\frac{\frac{6×1{0}^{-3}mol}{0.05L}}{2min}$=0.06mol•L-1•min-1,故答案为:0.06mol•L-1•min-1.
点评 本题考查了反应速率的测定及影响因素,中等难度,注意在比较外界反应条件对反应速率的影响时,要限定其他条件相同,改变一个条件,这是解题的依据.

| A. | 含有大量Fe3+的溶液中:Al3+、Cu2+、Cl-、SO42- | |
| B. | PH=1的溶液中:K+、Fe2+、NO${\;}_{3}^{-}$、SO${\;}_{4}^{2-}$ | |
| C. | 新鲜的空气中:SO2、NO、N2、NH3 | |
| D. | 所有氯气的集气瓶中:H2S、H2、HCl |
| A. | 无法确定 | B. | a<b | C. | a=b | D. | a>b |
| A. | 1mol•L-1NaHCO3溶液中,Na+数目为NA | |
| B. | 2.4gMg与足量盐酸完全反应时,失去电子数目为0.1NA | |
| C. | 等物质的量的N2和CO所含分子数、原子个数、电子总数均相同 | |
| D. | 标准状况下,11.2L的水中含有0.5个NA水分子 |
| A. | 向稀HNO3中滴加Na2SO3溶液SO32-+2H+═SO2↑+H2O | |
| B. | CuSO4溶液与H2S反应的离子方程式:Cu2++S2-═CuS↓ | |
| C. | 氯气溶于水:Cl2+H2═2H++Cl-+ClO- | |
| D. | 向CuSO4溶液中加入Na2O2:2Na2O2+2Cu2++2H2═4Na++2Cu(OH)2↓+O2↑ |
| A. | 氯气的性质活泼,它与氢气混合后立即发生爆炸 | |
| B. | 实验室制取氯气时,为了防止污染,多余氯气用氢氧化钙溶液吸收 | |
| C. | 新制氯水的酸性强于久置氯水 | |
| D. | 向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+ |
| A. | 加入烧碱 | B. | 加入盐酸 | C. | 升高温度 | D. | 加水 |
| A. | 2Al+6HCl═2 AlCl3+3H2 | B. | 4Na+O2═2Na2O | ||
| C. | MgO+H2SO4═MgSO4+2H2O | D. | Ba(OH)2+H2SO4═BaSO4↓+2H2O |