题目内容
9. 氯化亚砜用于医药、农药、染料工业及有机合成工业,常作氯化剂,制锂氯化亚砜(Li/SOCl2)电池.工业上用SO2、SCl2与Cl2反应合成SO2(g)+Cl2(g)+SCl2(g)?2SOCl2(g).
氯化亚砜用于医药、农药、染料工业及有机合成工业,常作氯化剂,制锂氯化亚砜(Li/SOCl2)电池.工业上用SO2、SCl2与Cl2反应合成SO2(g)+Cl2(g)+SCl2(g)?2SOCl2(g).(1)在373K时,向2L的密闭容器中通入SO2、SCl2与Cl2均为0.04mol,发生上述反应.测得其压强(p)随时间(t)的变化为表中数据I(反应达到平衡时的温度与起始温度相同).
| t/min | 0 | 1 | 2 | 3 | 4 | 5 | |
| I | p | 6.0p0 | 6.7p0 | 6.1p0 | 5.4p0 | 5.0p0 | 5.0p0 |
| II | p | 6.0p0 | 7.0p0 | 5.3p0 | 5.0p0 | 5.0p0 | 5.0p0 |
①该反应的△H<(填“>”“<”或“=”)0.
②反应开始至达到平衡时,v(SOCl2)=0.005mol/(L•min).
③若只改变某一条件,其他条件相同时,测得其压强随时间的变化为表中数据II,则改变的条件是使用催化剂.
(2)如图是某同学测定上述反应的平衡常数的对数值(lgK)与温度的变化关系点.
①A点的数值为2.6.(已知:lg4=0.6)
②当升高到某一温度时,反应重新达到平衡,A点可能变化为BE点.
(3)已知反应S4(g)+4Cl2(g)═4SCl2(g) 的△H=-4kJ•mol-1,1molS4(g)、1molSCl2(g)分子中化学键断裂时分别需要吸收1064kJ、510kJ的能量,则1molCl2(g)分子中化学键断裂时需吸收的能量为243kJ.
(4)某种锂电池的负极由金属锂构成,正极由二氯亚砜(SOCl2)和碳材料构成.总反应为:4Li+2SOCl2═4LiCl+S+SO2↑,此种锂电池是一次电池,在放电时有气体产生.此电池工作时正极的电极反应式为2SOCl2+4e-=S+SO2↑+4Cl-,电解质中锂离子定向移向正极极(填“正极”或“负极”).
分析 (1)①根据温度对化学平衡的影响考虑;
②向2L的密闭容器中通入SO2、SCl2与Cl2均为0.04mol,设参与反应的为SO2为x,列三段式,根据温度相同、体积相同,气体的物质的量之比=气体的压强之比,解得x,再由v=$\frac{△c}{△t}$计算;
③II与Ⅰ比较,反应速率加快,但平衡状态一样,应为使用催化剂;
(2)①根据化学平衡常数为生成物浓度幂之积与反应物浓度幂之积之比计算;
②根据温度对化学平衡的影响结合对数可得;
(3)由△H=反应物的总键能-生成物的总键能计算可得;
(4)正极得电子发生还原反应,结合总反应产物可得正极电极反应式;阳离子移向正极.
解答 解:(1)①升高温度,K值减小,该反应为放热反应,该反应的△H<0,故答案为:<;
②向2L的密闭容器中通入SO2、SCl2与Cl2均为0.04mol,设参与反应的为SO2为x,则:
SO2(g)+Cl2(g)+SCl2(g)?2SOCl2(g)
n始:0.04 0.04 0.04 0
n转:x x x 2x
n平:0.04-x 0.04-x 0.04-x 2x
由表可知,4min达到平衡,温度相同、体积相同,气体的物质的量之比=气体的压强之比,则 $\frac{{p}_{平}}{{p}_{始}}$=$\frac{0.12-x}{0.12}$=$\frac{5.0p0}{6.0p0}$,解得x=0.02mol,则反应开始至达到平衡时,v(SOCl2)=$\frac{0.02mol×2÷2L}{4min}$=0.005mol/(L•min);
故答案为:0.005mol/(L•min);
③II与Ⅰ比较,达到平衡所用时间段,说明反应速率加快,但平衡状态一样,应为使用催化剂;
故答案为:使用催化剂;
(2)①根据(1)可知,373K时:
SO2(g)+Cl2(g)+SCl2(g)?2SOCl2(g)
c平:0.01 0.01 0.01 0.02
则化学平衡常数K=$\frac{0.0{2}^{2}}{0.0{1}^{3}}$=400,则A点的数值为lgK=lg400=2.6;
故答案为:2.6
②该反应为放热反应,升高温度,K值减小,lgK减小,故A可能变化为B、E两点;
故答案为:BE;
(3)反应S4(g)+4Cl2(g)═4SCl2(g)的△H=-4kJ•mol-1,1molS4(g)、1molSCl2(g)分子中化学键断裂时分别需要吸收1064kJ、510kJ的能量,设1molCl2(g)分子中化学键断裂时需吸收的能量为Q,则△H=1064+4×Q-4×510=-4,解得Q=243;
故答案为:243;
(4)正极得电子发生还原反应,结正极电极反应式为:2SOCl2+4e-=S+SO2↑+4Cl-;阳离子移向正极,所以电解质中锂离子移向正极,
故答案为:2SOCl2+4e-=S+SO2↑+4Cl-;正极.
点评 本题考查了化学平衡的有关计算,温度对化学平衡的影响,键能与反应热的关系以及原电池的原理,综合性强,题目难度不大,考生注意基础知识的把握与计算.

 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案| A. | Al2(SO4)3═2Al3++3SO42- | B. | NaHCO3═Na++H++CO32- | ||
| C. | H2O═O2-+2H+ | D. | Na2CO3═Na2++CO32- |
 ,乙苯脱氢反应的平衡常数K如表所示;在体积为1 L的恒容密闭容器中充入0.2 mol乙苯蒸汽,在不同温度下进行乙苯脱氢反应.
,乙苯脱氢反应的平衡常数K如表所示;在体积为1 L的恒容密闭容器中充入0.2 mol乙苯蒸汽,在不同温度下进行乙苯脱氢反应.| T/K | 700 | 800 | 900 | 1 000 | 1 100 |
| K | 3.3×10-2 | 4.71×10-2 | 0.10 | 2.00 | 7.87 |
| A. | 乙苯脱氢反应是放热反应 | |
| B. | 800℃下达到平衡时,苯乙烯的体积分数为40% | |
| C. | 900℃下达到平衡时,乙苯的转化率为50% | |
| D. | 1 000℃下达到平衡时,H2的浓度为0.075 mol•L-1 |
 碳氧化物研究
碳氧化物研究(1)在体积可变 (活塞与容器之间的摩擦力忽略不计)的密闭容器如右图所示,现将3molH2和2molCO放入容器中,移动活塞至体积V为2L,用铆钉固定在A、B点,发生合成甲醇的反应如下:CO(g)+2H2(g)═CH3OH(g),测定不同条件、不同时间段内的CO的转化率,得到如表数据:
| CO的转化率 T(℃) | 10min | 20min | 30min | 40min |
| T1 | 20% | 55% | 65% | 65% |
| T2 | 35% | 50% | a1 | a2 |
②T2℃下,第40min时,拔去铆钉(容器密封性良好)后,活塞没有发生移动,再向容器中通人6molCO,此时v(正)< v(逆)(选填“>”、“<”或“=”).
③现有以下几种情况放入该体积可变的密闭容器中,请选出T2℃下达到的平衡状态与①中T2℃下的平衡状态一致的是
A、2mol H2+1molCO+1molCH3OH
B、0.5mol H2+1.5molCH3OH
C、1mol H2+1molCO+1molCH3OH
D、2mol H2+4molCH3OH
(2)一定条件下可用甲醇与CO反应生成醋酸消除CO污染.常温下,将a mol/L的醋酸与b mol/L Ba(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(CH3COO-),则该混合溶液中醋酸的电离常数Ka=$\frac{2b}{a-2b}$×10-7L/mol(用含a和b的代数式表示).
| A. | 第二个反应的平衡常数为1 | |
| B. | 第二个反应的平衡常数为0.05 | |
| C. | 第二个反应达到平衡时,H2的平衡浓度为0.25mol/L | |
| D. | 第二个反应达到平衡时,HI(g)的平衡浓度为0.25 mol/L |
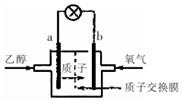 乙醇燃料电池中采用磺酸类质子溶剂,在200℃左右时供电,电池总反应为:
乙醇燃料电池中采用磺酸类质子溶剂,在200℃左右时供电,电池总反应为:C2H5OH+302=2CO2+3H2O,电池示意如图.下列说法中正确的是( )
| A. | 电池工作时.质子向电池的负极迁移 | |
| B. | 电池工作时.电子由b极沿导线流向a极 | |
| C. | a极上发生的电极反应是:C2H5OH+3H2O+12e一=2CO2+12H+ | |
| D. | -b极上发生的电极反应是:4H++O2+4e一=2H2O |
 ,
,