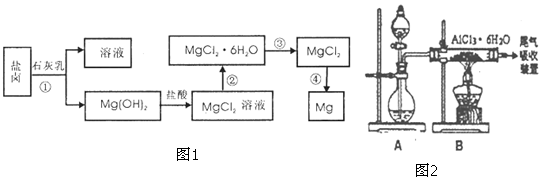
��Ŀ����
4����ҵ��ͨ���ұ������ñ���ϩ�� ���ұ����ⷴӦ��ƽ�ⳣ��K�����ʾ�������Ϊ1 L�ĺ����ܱ������г���0.2 mol�ұ��������ڲ�ͬ�¶��½����ұ����ⷴӦ��
���ұ����ⷴӦ��ƽ�ⳣ��K�����ʾ�������Ϊ1 L�ĺ����ܱ������г���0.2 mol�ұ��������ڲ�ͬ�¶��½����ұ����ⷴӦ��| T/K | 700 | 800 | 900 | 1 000 | 1 100 |
| K | 3.3��10-2 | 4.71��10-2 | 0.10 | 2.00 | 7.87 |
| A�� | �ұ����ⷴӦ�Ƿ��ȷ�Ӧ | |
| B�� | 800���´ﵽƽ��ʱ������ϩ���������Ϊ40% | |
| C�� | 900���´ﵽƽ��ʱ���ұ���ת����Ϊ50% | |
| D�� | 1 000���´ﵽƽ��ʱ��H2��Ũ��Ϊ0.075 mol•L-1 |
���� �ɱ������ݿ�֪���¶�Խ�ߣ�ƽ�ⳣ��Խ�����¶ȶ�ƽ���ƶ���μӷ�Ӧ��Ӱ�������
���ұ�ת����xmol/L
 ��
��
��ʼŨ�ȣ�mol/L����0.2 0 0
ת��Ũ�ȣ�mol/L����x x x
ƽ��Ũ�ȣ�mol/L����0.2-x x x
ƽ�ⳣ��K=$\frac{c��{H}_{2}����c������ϩ��}{c���ұ���}$����ϲ�ͬ�¶��µ�ƽ�ⳣ�����㣮
��� �⣺A���ɱ������ݿ�֪���¶�Խ�ߣ�ƽ�ⳣ��Խ��˵�������¶�ƽ�����������ƶ�����������Ϊ���ȷ�Ӧ����A����
B��800��ʱ��K=4.71��10-2�����ұ�ת����xmol/L
 ��
��
��ʼŨ�ȣ�mol/L����0.2 0 0
ת��Ũ�ȣ�mol/L����x x x
ƽ��Ũ�ȣ�mol/L����0.2-x x x
������ϩ���������Ϊ40%����$\frac{x}{0.2-x+x+x}$=0.4�����x=0.13�����¶ȵ�K=$\frac{c��{H}_{2}����c������ϩ��}{c���ұ���}$=$\frac{0.13��0.13}{0.2-0.13}$��4.71��10-2����B����
C��ͬ��900�棬K=0.1��ʱ�����ұ�ת����xmol/L ��K=$\frac{{x}^{2}}{0.2-x}$=0.1�����x=0.1�����ұ���ת����Ϊ$\frac{0.1}{0.2}��100%$=50%����C��ȷ��
D��ͬ��1000��ʱ��K=2�����ﵽƽ��ʱ��H2��Ũ��Ϊ0.075 mol•L-1����
 ��
��
ƽ��Ũ�ȣ�mol/L����0.2-0.075 0.075 0.075
��ѧƽ�ⳣ��K=$\frac{0.07{5}^{2}}{0.2-0.075}$��2����D����
��ѡC��
���� �����֪ʶ��Ϊ���ò�ͬ�¶��µ�ƽ�ⳣ�����м��㣬��Ŀ�ѶȲ����Ǽ������ϴ�ע�����ü��ɣ������淴˼ά���㣮

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�| A�� | Fe+2HCl�TFeCl2+H2�� | |
| B�� | 2HCl+Ca��ClO��2�T2HClO+CaCl2 | |
| C�� | I2+2NaClO3�T2NaIO3+Cl2�� | |
| D�� | 4HCl��Ũ��+MnO2$\frac{\underline{\;\;��\;\;}}{\;}$MnCl2+Cl2��+2H2O |
 �Ȼ���������ҽҩ��ũҩ��Ⱦ�Ϲ�ҵ���л��ϳɹ�ҵ�������Ȼ���������Ȼ�������Li/SOCl2����أ���ҵ����SO2��SCl2��Cl2��Ӧ�ϳ�SO2��g��+Cl2��g��+SCl2��g��?2SOCl2��g����
�Ȼ���������ҽҩ��ũҩ��Ⱦ�Ϲ�ҵ���л��ϳɹ�ҵ�������Ȼ���������Ȼ�������Li/SOCl2����أ���ҵ����SO2��SCl2��Cl2��Ӧ�ϳ�SO2��g��+Cl2��g��+SCl2��g��?2SOCl2��g������1����373Kʱ����2L���ܱ�������ͨ��SO2��SCl2��Cl2��Ϊ0.04mol������������Ӧ�������ѹǿ��p����ʱ�䣨t���ı仯Ϊ��������I����Ӧ�ﵽƽ��ʱ���¶�����ʼ�¶���ͬ����
| t/min | 0 | 1 | 2 | 3 | 4 | 5 | |
| I | p | 6.0p0 | 6.7p0 | 6.1p0 | 5.4p0 | 5.0p0 | 5.0p0 |
| II | p | 6.0p0 | 7.0p0 | 5.3p0 | 5.0p0 | 5.0p0 | 5.0p0 |
�ٸ÷�Ӧ�ġ�H�����������������=����0��
�ڷ�Ӧ��ʼ���ﵽƽ��ʱ��v��SOCl2��=0.005mol/��L•min����
����ֻ�ı�ijһ����������������ͬʱ�������ѹǿ��ʱ��ı仯Ϊ��������II����ı��������ʹ�ô�����
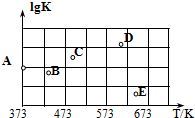
��2����ͼ��ijͬѧ�ⶨ������Ӧ��ƽ�ⳣ���Ķ���ֵ��lgK�����¶ȵı仯��ϵ�㣮
��A�����ֵΪ2.6������֪��lg4=0.6��
�ڵ����ߵ�ijһ�¶�ʱ����Ӧ���´ﵽƽ�⣬A����ܱ仯ΪBE�㣮
��3����֪��ӦS4��g��+4Cl2��g���T4SCl2��g�� �ġ�H=-4kJ•mol-1��1molS4��g����1molSCl2��g�������л�ѧ������ʱ�ֱ���Ҫ����1064kJ��510kJ����������1molCl2��g�������л�ѧ������ʱ�����յ�����Ϊ243kJ��
��4��ij��﮵�صĸ����ɽ���﮹��ɣ������ɶ���������SOCl2����̼���Ϲ��ɣ��ܷ�ӦΪ��4Li+2SOCl2�T4LiCl+S+SO2��������﮵����һ�ε�أ��ڷŵ�ʱ������������˵�ع���ʱ�����ĵ缫��ӦʽΪ2SOCl2+4e-=S+SO2��+4Cl-�������������Ӷ��������������������������������

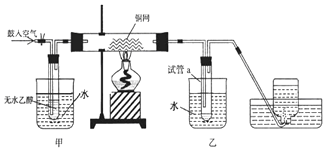
 �ݱ�����һ�������� Fe2O3�ɱ����黹ԭΪ���������Ľ��������䷴ӦΪ��Fe2O3��s��+3CH4��g��?2Fe��s��+3CO��g��+6H2��g��
�ݱ�����һ�������� Fe2O3�ɱ����黹ԭΪ���������Ľ��������䷴ӦΪ��Fe2O3��s��+3CH4��g��?2Fe��s��+3CO��g��+6H2��g��