题目内容
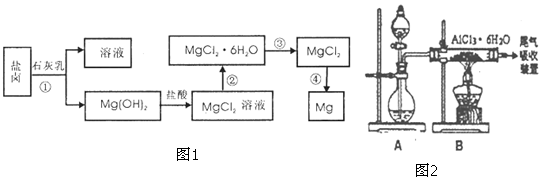
19. 乙醇燃料电池中采用磺酸类质子溶剂,在200℃左右时供电,电池总反应为:
乙醇燃料电池中采用磺酸类质子溶剂,在200℃左右时供电,电池总反应为:C2H5OH+302=2CO2+3H2O,电池示意如图.下列说法中正确的是( )
| A. | 电池工作时.质子向电池的负极迁移 | |
| B. | 电池工作时.电子由b极沿导线流向a极 | |
| C. | a极上发生的电极反应是:C2H5OH+3H2O+12e一=2CO2+12H+ | |
| D. | -b极上发生的电极反应是:4H++O2+4e一=2H2O |
分析 由质子的移动方向可知a为负极,a极上是乙醇失电子发生氧化反应,乙醇被氧化生成CO2和H+,电极反应式为C2H5OH+3H2O-12e-═2CO2+12H+,b为正极,发生还原反应,电极方程式为4H++O2+4e-═2H2O,以此解答该题.
解答 解:A、电池中,阳离子向正极移动,所以质子向电池的正极迁移,故A错误;
B、电池工作时,电子由负极经外电路流向正极,在该电池中由a极流向b极,故B错误;
C、a极上是乙醇失电子发生氧化反应,乙醇被氧化生成CO2和H+,电极反应式为C2H5OH+3H2O-12e-═2CO2+12H+,故C错误;
D、正极氧气得到电子被还原,电极反应式为4H++O2+4e-=2H2O,故D正确.
故选:D.
点评 本题考查原电池知识,题目难度中等,本题注意把握根据电池总反应书写电极方程式的方法.

练习册系列答案
相关题目
9. 氯化亚砜用于医药、农药、染料工业及有机合成工业,常作氯化剂,制锂氯化亚砜(Li/SOCl2)电池.工业上用SO2、SCl2与Cl2反应合成SO2(g)+Cl2(g)+SCl2(g)?2SOCl2(g).
氯化亚砜用于医药、农药、染料工业及有机合成工业,常作氯化剂,制锂氯化亚砜(Li/SOCl2)电池.工业上用SO2、SCl2与Cl2反应合成SO2(g)+Cl2(g)+SCl2(g)?2SOCl2(g).
(1)在373K时,向2L的密闭容器中通入SO2、SCl2与Cl2均为0.04mol,发生上述反应.测得其压强(p)随时间(t)的变化为表中数据I(反应达到平衡时的温度与起始温度相同).
请回答下列问题:
①该反应的△H<(填“>”“<”或“=”)0.
②反应开始至达到平衡时,v(SOCl2)=0.005mol/(L•min).
③若只改变某一条件,其他条件相同时,测得其压强随时间的变化为表中数据II,则改变的条件是使用催化剂.
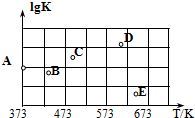
(2)如图是某同学测定上述反应的平衡常数的对数值(lgK)与温度的变化关系点.
①A点的数值为2.6.(已知:lg4=0.6)
②当升高到某一温度时,反应重新达到平衡,A点可能变化为BE点.
(3)已知反应S4(g)+4Cl2(g)═4SCl2(g) 的△H=-4kJ•mol-1,1molS4(g)、1molSCl2(g)分子中化学键断裂时分别需要吸收1064kJ、510kJ的能量,则1molCl2(g)分子中化学键断裂时需吸收的能量为243kJ.
(4)某种锂电池的负极由金属锂构成,正极由二氯亚砜(SOCl2)和碳材料构成.总反应为:4Li+2SOCl2═4LiCl+S+SO2↑,此种锂电池是一次电池,在放电时有气体产生.此电池工作时正极的电极反应式为2SOCl2+4e-=S+SO2↑+4Cl-,电解质中锂离子定向移向正极极(填“正极”或“负极”).
 氯化亚砜用于医药、农药、染料工业及有机合成工业,常作氯化剂,制锂氯化亚砜(Li/SOCl2)电池.工业上用SO2、SCl2与Cl2反应合成SO2(g)+Cl2(g)+SCl2(g)?2SOCl2(g).
氯化亚砜用于医药、农药、染料工业及有机合成工业,常作氯化剂,制锂氯化亚砜(Li/SOCl2)电池.工业上用SO2、SCl2与Cl2反应合成SO2(g)+Cl2(g)+SCl2(g)?2SOCl2(g).(1)在373K时,向2L的密闭容器中通入SO2、SCl2与Cl2均为0.04mol,发生上述反应.测得其压强(p)随时间(t)的变化为表中数据I(反应达到平衡时的温度与起始温度相同).
| t/min | 0 | 1 | 2 | 3 | 4 | 5 | |
| I | p | 6.0p0 | 6.7p0 | 6.1p0 | 5.4p0 | 5.0p0 | 5.0p0 |
| II | p | 6.0p0 | 7.0p0 | 5.3p0 | 5.0p0 | 5.0p0 | 5.0p0 |
①该反应的△H<(填“>”“<”或“=”)0.
②反应开始至达到平衡时,v(SOCl2)=0.005mol/(L•min).
③若只改变某一条件,其他条件相同时,测得其压强随时间的变化为表中数据II,则改变的条件是使用催化剂.
(2)如图是某同学测定上述反应的平衡常数的对数值(lgK)与温度的变化关系点.
①A点的数值为2.6.(已知:lg4=0.6)
②当升高到某一温度时,反应重新达到平衡,A点可能变化为BE点.
(3)已知反应S4(g)+4Cl2(g)═4SCl2(g) 的△H=-4kJ•mol-1,1molS4(g)、1molSCl2(g)分子中化学键断裂时分别需要吸收1064kJ、510kJ的能量,则1molCl2(g)分子中化学键断裂时需吸收的能量为243kJ.
(4)某种锂电池的负极由金属锂构成,正极由二氯亚砜(SOCl2)和碳材料构成.总反应为:4Li+2SOCl2═4LiCl+S+SO2↑,此种锂电池是一次电池,在放电时有气体产生.此电池工作时正极的电极反应式为2SOCl2+4e-=S+SO2↑+4Cl-,电解质中锂离子定向移向正极极(填“正极”或“负极”).
7.设NA表示阿伏加德常数的值,下列叙述正确的是( )
| A. | 足量铁在1molCl2中燃烧时转移电子数为2NA | |
| B. | 2L0.1mol•L-1氯化钾溶液中阴离子所带电荷数为NA | |
| C. | 1L0.1mol•L-1的Na2CO3溶液中HCO3-和CO32-离子数之和为0.1NA | |
| D. | 标准状况下,体积各为2.24L的HCl和NH3混合气体中含有的共价键数为0.25NA |
4.把金属钠投入到下列稀溶液中,溶液质量会减轻的是( )
| A. | HCl | B. | (NH4)2SO4 | C. | CaCl2 | D. | CuSO4 |
11.已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D是地壳中含量最多的金属元素.下列说法正确的是( )
| A. | B的单质在自然界只有一种核素 | |
| B. | 元素C、D、E的简单离子的半径依次减小 | |
| C. | A、E分别与C形成的化合物中含有一种相同类型的化学键 | |
| D. | 这几种元素可能形成的简单离子中E的简单离子的还原性最强 |
 . 该反应的离子方程式为Fe3S4+6H+=3Fe2++S+3H2S↑.
. 该反应的离子方程式为Fe3S4+6H+=3Fe2++S+3H2S↑.