题目内容
14.碳和碳的化合物在生产、生活中有重要作用,甲醇水蒸气重整制氢系统可能发生下列三个反应:①CH3OH(g)?CO(g)+2H2(g)△H1=+90.8kJ/mol
②CH3OH(g)+H2O(g)?CO2(g)+3H2(g)△H2=+49kJ/mol
③CO(g)+H2O(g)?CO2(g)+H2(g)△H3
回答下列问题:
(1)△H3=-41.8 kJ/mol;
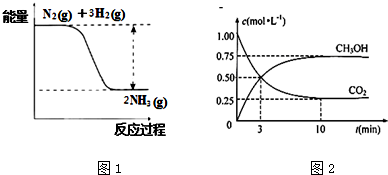
(2)以CO、H2为原料合成甲醇的反应为:CO(g)+2H2(g)═CH3OH(g).在体积均为2L的三个恒容密闭容器Ⅰ、Ⅱ、Ⅲ中,分别都充入1molCO和2molH2,三个容器的反应温度分别为T1、T2、T3且恒定不变.图1为三个容器中的反应均进行到5min时H2的体积分数示意图,其中有一个容器反应一定达到平衡状态.CO的平衡转化率在不同压强下随温度的变化如图2所示.

①0~5min时间内容器II中用CH3OH表示的反应速率为0.0875mol/(L•min).
②三个容器中一定达到平衡状态的是容器II.
③平衡常数最大的是容器I.
④工业实际合成CH3OH生产中,常用图中M点而不是N点对应的反应条件,运用化学反应速率和平衡知识,同时考虑生产实际,说明选择该反应条件的理由:相对于N点而言,采用M点,温度在500-600K之间,温度较高,反应速率较快,氢气的平衡转化率也较高,压强为常压对设备要求不高.
(3)甲醇使用不当会造成其对水质的污染,用电化学可消除这种污染,其原理是电解CoSO4、稀硫酸和CH3OH混合溶液,将Co2+氧化成Co3+,Co3+再将CH3OH氧化成CO2.
①电解时,阳极的电极反应式为Co2+-e-═Co3+;
②Co3+氧化CH3OH的离子方程式为6Co3++CH3OH+H2O═CO2↑+6Co2++6 H+.
(4)控制反应条件,反应①中的产物也可以用来合成甲醇和二甲醚,其中合成二甲醚的化学方程式为3H2(g)+3CO(g)═CH3OCH3(g)+CO2(g),对于气相反应,用某组分(B)的平衡分压(PB)代替物质的量浓度(cB)也可以表示平衡常数(记作KP),水煤气合成二甲醚的反应的平衡常数表达式为KP=$\frac{p(C{H}_{3}OC{H}_{3})p(C{O}_{2})}{{p}^{3}({H}_{2}){p}^{3}(CO)}$.
分析 (1)依据热化学方程式和盖斯定律计算得到所需热化学方程式的焓变;
(2)①利用三段式求出反应生成的甲醇的物质的量浓度,再根据v=$\frac{△c}{△t}$计算;
②达到平衡状态时氢气的转化率最大,氢气的体积分数最小;
③该反应为放热反应,温度越低,反应向正方向进行的程度越大;
④根据温度、压强对反应速率的影响以及对设备的要求分析;
(3)①将Co2+氧化为Co3+,电极上发生失电子的氧化反应;
②Co3+将甲醇氧化为二氧化碳,本身被还原为Co,电解质环境是酸性的,根据电子守恒配平方程式即可;
(4)3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g),反应的平衡常数KP表达式为生成物平衡分压幂次方乘积除以反应物平衡分压幂次方乘积.
解答 解:(1)①CH3OH(g)?CO(g)+2H2(g)△H2=+90.8kJ/mol
②CH3OH(g)+H2O(g)?CO2(g)+3H2(g)△H2=+49kJ/mol
依据盖斯定律计算②-①得到③:CO(g)+H2O(g)?CO2(g)+H2(g)△H3=-41.8 kJ/mol,
故答案为:-41.8 kJ/mol;
(2)①设反应生成的甲醇物质的量为x,
CO(g)+2H2(g)═CH3OH(g)
开始(mol):1 2 0
转化(mol):x 2x x
平衡(mol):1-x 2-2x x
到5min时,氢气的体积分数为0.2,则$\frac{2-2x}{(1-x)+(2-2x)+x}$=0.2,则x=$\frac{7}{8}$,
则v=$\frac{△c}{△t}$=$\frac{\frac{\frac{7}{8}mol}{2L}}{5min}$=0.0875mol/(L•min),
故答案为:0.0875mol/(L•min);
②达到平衡状态时氢气的转化率最大,氢气的体积分数最小,II对应的氢气的体积分数最小,所以II可能达到了平衡状态;
故答案为:II;
故答案为:0.0875mol/(L•min);②Ⅲ;(1分)
③由图2可知,升高温度CO的转化率减小,即向逆反应移动,所以该反应为放热反应,温度越低,反应向正方向进行的程度越大,K越大,已知I的温度最低,则其K最大;
故答案为:I;
④相对于N点而言,采用M点,温度在500-600K之间,温度较高,反应速率较快,氢气的平衡转化率也较高,压强为常压对设备要求不高,
故答案为:相对于N点而言,采用M点,温度在500-600K之间,温度较高,反应速率较快,氢气的平衡转化率也较高,压强为常压对设备要求不高;
(3)①其原理是电解CoSO4、稀硫酸和CH3OH的混合溶液,将Co2+氧化为Co3+,Co3+再将CH3OH氧化成CO2.
电解池中该电极上发生失电子的氧化反应,电极反应为:Co2+-e-═Co3+,
故答案为:Co2+-e-═Co3+;
②Co3+将甲醇氧化为二氧化碳,本身被还原为Co,即6Co3++CH3OH+H2O═CO2↑+6Co2++6H+;
故答案为:6Co3++CH3OH+H2O═CO2↑+6Co2++6 H+;
(4)3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g),反应的平衡常数KP表达式为生成物平衡分压幂次方乘积除以反应物平衡分压幂次方乘积$\frac{p(C{H}_{3}OC{H}_{3})p(C{O}_{2})}{{p}^{3}({H}_{2}){p}^{3}(CO)}$;
故答案为:$\frac{p(C{H}_{3}OC{H}_{3})p(C{O}_{2})}{{p}^{3}({H}_{2}){p}^{3}(CO)}$.
点评 本题考查了反应热的计算、化学平衡计算与影响因素、化学平衡图象、反应速率与平衡常数、电解原理的应用等,注意理解掌握化学平衡的计算方法,难度中等,侧重于考查学生的分析能力和计算能力.

| 实验序号 | 实验内容 | 实验结果 |
| 1 | 加AgNO3溶液 | 有白色沉淀生成 |
| 2 | 加足量NaOH溶液并加热 | 收集到气体1.12L(已折算成标准状况下的体积) |
| 3 | 加足量BaCl2溶液,反应后进行过滤、洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后干燥、称量 | 第一次称量读数为6.27g,第二次称量读数为2.33g |
(1)根据实验1~3判断混合物中一定不存在的离子是Mg2+、Ba2+;
(2)写出实验3中的空格处的实验操作过滤、洗涤;
(3)根据实验对Cl-是否存在的判断是不能确定(填“一定存在”、“一定不存在”或“不能确定”);
(4)溶液中K+是否存在?一定存在(填“一定存在”、“一定不存在”或“不能确定”);若“一定存在”,则K+物质的量浓度的范围>0.1 mol•L-1(若“一定不存在”或“不能确定”不填此空).
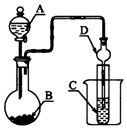
| A. | 若A为浓硫酸,B为Na2SO3固体,C中盛石蕊溶液,则C中溶液先变红后褪色 | |
| B. | 若A为醋酸溶液,B为贝壳,C中盛过量澄清石灰水,则C中溶液变浑浊 | |
| C. | 若A为浓盐酸,B为MnO2,C中盛品红溶液,则C中溶液不褪色 | |
| D. | 若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中产生白色沉淀 |
 氯化亚砜用于医药、农药、染料工业及有机合成工业,常作氯化剂,制锂氯化亚砜(Li/SOCl2)电池.工业上用SO2、SCl2与Cl2反应合成SO2(g)+Cl2(g)+SCl2(g)?2SOCl2(g).
氯化亚砜用于医药、农药、染料工业及有机合成工业,常作氯化剂,制锂氯化亚砜(Li/SOCl2)电池.工业上用SO2、SCl2与Cl2反应合成SO2(g)+Cl2(g)+SCl2(g)?2SOCl2(g).(1)在373K时,向2L的密闭容器中通入SO2、SCl2与Cl2均为0.04mol,发生上述反应.测得其压强(p)随时间(t)的变化为表中数据I(反应达到平衡时的温度与起始温度相同).
| t/min | 0 | 1 | 2 | 3 | 4 | 5 | |
| I | p | 6.0p0 | 6.7p0 | 6.1p0 | 5.4p0 | 5.0p0 | 5.0p0 |
| II | p | 6.0p0 | 7.0p0 | 5.3p0 | 5.0p0 | 5.0p0 | 5.0p0 |
①该反应的△H<(填“>”“<”或“=”)0.
②反应开始至达到平衡时,v(SOCl2)=0.005mol/(L•min).
③若只改变某一条件,其他条件相同时,测得其压强随时间的变化为表中数据II,则改变的条件是使用催化剂.
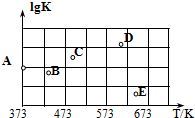
(2)如图是某同学测定上述反应的平衡常数的对数值(lgK)与温度的变化关系点.
①A点的数值为2.6.(已知:lg4=0.6)
②当升高到某一温度时,反应重新达到平衡,A点可能变化为BE点.
(3)已知反应S4(g)+4Cl2(g)═4SCl2(g) 的△H=-4kJ•mol-1,1molS4(g)、1molSCl2(g)分子中化学键断裂时分别需要吸收1064kJ、510kJ的能量,则1molCl2(g)分子中化学键断裂时需吸收的能量为243kJ.
(4)某种锂电池的负极由金属锂构成,正极由二氯亚砜(SOCl2)和碳材料构成.总反应为:4Li+2SOCl2═4LiCl+S+SO2↑,此种锂电池是一次电池,在放电时有气体产生.此电池工作时正极的电极反应式为2SOCl2+4e-=S+SO2↑+4Cl-,电解质中锂离子定向移向正极极(填“正极”或“负极”).
| A. | 夏天打开啤酒盖,喷出大量泡沫 | |
| B. | 工业上合成氨气时采用高温利于氨气的合成 | |
| C. | 在HI的分解实验达到平衡后加压颜色变深 | |
| D. | 锌和稀硫酸制备氢气时滴入少量硫酸铜可以加快速率 |
| A. | HCl | B. | (NH4)2SO4 | C. | CaCl2 | D. | CuSO4 |