题目内容
1. 碳氧化物研究
碳氧化物研究(1)在体积可变 (活塞与容器之间的摩擦力忽略不计)的密闭容器如右图所示,现将3molH2和2molCO放入容器中,移动活塞至体积V为2L,用铆钉固定在A、B点,发生合成甲醇的反应如下:CO(g)+2H2(g)═CH3OH(g),测定不同条件、不同时间段内的CO的转化率,得到如表数据:
| CO的转化率 T(℃) | 10min | 20min | 30min | 40min |
| T1 | 20% | 55% | 65% | 65% |
| T2 | 35% | 50% | a1 | a2 |
②T2℃下,第40min时,拔去铆钉(容器密封性良好)后,活塞没有发生移动,再向容器中通人6molCO,此时v(正)< v(逆)(选填“>”、“<”或“=”).
③现有以下几种情况放入该体积可变的密闭容器中,请选出T2℃下达到的平衡状态与①中T2℃下的平衡状态一致的是
A、2mol H2+1molCO+1molCH3OH
B、0.5mol H2+1.5molCH3OH
C、1mol H2+1molCO+1molCH3OH
D、2mol H2+4molCH3OH
(2)一定条件下可用甲醇与CO反应生成醋酸消除CO污染.常温下,将a mol/L的醋酸与b mol/L Ba(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(CH3COO-),则该混合溶液中醋酸的电离常数Ka=$\frac{2b}{a-2b}$×10-7L/mol(用含a和b的代数式表示).
分析 (1)①升高温度,化学反应速率加快,依此根据10min内,T2时CO转化率大于T1时判断温度的高低;
T2℃下,10min时CO转化率为35%,20min时CO转化率为50%,10-20min只转化15%,说明20min时已达平衡状态,依此判断第30min时CO转化率;
根据升高温度平衡常数减小判断;
②根据浓度商和平衡常数的大小关系,判断反应进行的方向;
③根据等效平衡考虑;
(2)溶液等体积混合溶质浓度减少一半,醋酸电离平衡常数与浓度无关,结合概念计算.
解答 解:(1)①升高温度,化学反应速率加快,10min内,T2时CO转化率大于T1时,故T2>T1;
T2℃下,10min时CO2转化率为35%,20min时CO2转化率为50%,10-20min只转化15%,说明20min时已达平衡状态,故第30min时,CO2转化率为50%;
根据T2平衡时CO转化率小于T1平衡时CO转化率,升高温度平衡常数减小;
故答案为:<;50%;减小;
②T2℃下,CO(g)+2H2(g)═CH3OH(g),
起始(mol) 2 3 0
转化(mol) 1 2 1
\平衡(mol) 1 1 1
K=$\frac{c(C{H}_{3}OH)}{c(CO)•{c}^{2}({H}_{2})}$=$\frac{\frac{1}{2}}{\frac{1}{2}×(\frac{1}{2})^{2}}$=4
T2℃下,原反应达平衡时,一氧化碳的物质的量为1mol,氢气的物质的量为1mol,甲醇蒸气的物质的量为1mol,则气体总的物质的量为3mol,T2℃下,第40min时,拔去铆钉(容器密封性良好)后,活塞没有发生移动.再向容器中通入6molCO,则容器体积变为原来的3倍,即2L×3=6L,Qc=$\frac{\frac{1}{6}}{\frac{7}{6}×(\frac{1}{6})^{2}}$=$\frac{36}{7}$>K,故平衡逆向移动,v(正)<v(逆),
故答案为:<;
③A、2mol H2+1molCO+1molCH3OH,可看成多加1molH2,故平衡状态不一致,不选A;
B、0.5mol H2+1.5molCH3OH,可看成少加1molH2和1.5molCO,故平衡状态不一致,不选B;
C、1mol H2+1molCO+1molCH3OH,故平衡状态一致,选C;
D、2mol H2+4molCH3OH,可看成少加2molH2和4molCO,故平衡状态不一致,不选D;
故答案为:C;
(2)反应平衡时,2c(Ba2+)=c(CH3COO-)=bmol/L,据电荷守恒,溶液中c(H+)=c(OH-)=10-7mol/L,溶液呈中性,醋酸电离平衡常数依据电离方程式写出K=$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$=$\frac{b×1{0}^{-7}}{\frac{a}{2}-b}$=$\frac{2b}{a-2b}$×10-7;
用含a和b的代数式表示该混合溶液中醋酸的电离常数为$\frac{2b}{a-2b}$×10-7L/mol,
故答案为:$\frac{2b}{a-2b}$×10-7L/mol.
点评 本题考查化学反应速率影响因素及相关计算、化学平衡的移动原理、平衡常数的相关计算等知识,难度较大.

 氯化亚砜用于医药、农药、染料工业及有机合成工业,常作氯化剂,制锂氯化亚砜(Li/SOCl2)电池.工业上用SO2、SCl2与Cl2反应合成SO2(g)+Cl2(g)+SCl2(g)?2SOCl2(g).
氯化亚砜用于医药、农药、染料工业及有机合成工业,常作氯化剂,制锂氯化亚砜(Li/SOCl2)电池.工业上用SO2、SCl2与Cl2反应合成SO2(g)+Cl2(g)+SCl2(g)?2SOCl2(g).(1)在373K时,向2L的密闭容器中通入SO2、SCl2与Cl2均为0.04mol,发生上述反应.测得其压强(p)随时间(t)的变化为表中数据I(反应达到平衡时的温度与起始温度相同).
| t/min | 0 | 1 | 2 | 3 | 4 | 5 | |
| I | p | 6.0p0 | 6.7p0 | 6.1p0 | 5.4p0 | 5.0p0 | 5.0p0 |
| II | p | 6.0p0 | 7.0p0 | 5.3p0 | 5.0p0 | 5.0p0 | 5.0p0 |
①该反应的△H<(填“>”“<”或“=”)0.
②反应开始至达到平衡时,v(SOCl2)=0.005mol/(L•min).
③若只改变某一条件,其他条件相同时,测得其压强随时间的变化为表中数据II,则改变的条件是使用催化剂.
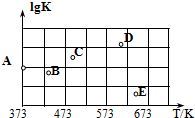
(2)如图是某同学测定上述反应的平衡常数的对数值(lgK)与温度的变化关系点.
①A点的数值为2.6.(已知:lg4=0.6)
②当升高到某一温度时,反应重新达到平衡,A点可能变化为BE点.
(3)已知反应S4(g)+4Cl2(g)═4SCl2(g) 的△H=-4kJ•mol-1,1molS4(g)、1molSCl2(g)分子中化学键断裂时分别需要吸收1064kJ、510kJ的能量,则1molCl2(g)分子中化学键断裂时需吸收的能量为243kJ.
(4)某种锂电池的负极由金属锂构成,正极由二氯亚砜(SOCl2)和碳材料构成.总反应为:4Li+2SOCl2═4LiCl+S+SO2↑,此种锂电池是一次电池,在放电时有气体产生.此电池工作时正极的电极反应式为2SOCl2+4e-=S+SO2↑+4Cl-,电解质中锂离子定向移向正极极(填“正极”或“负极”).
| A. | 夏天打开啤酒盖,喷出大量泡沫 | |
| B. | 工业上合成氨气时采用高温利于氨气的合成 | |
| C. | 在HI的分解实验达到平衡后加压颜色变深 | |
| D. | 锌和稀硫酸制备氢气时滴入少量硫酸铜可以加快速率 |
| A. | B的单质在自然界只有一种核素 | |
| B. | 元素C、D、E的简单离子的半径依次减小 | |
| C. | A、E分别与C形成的化合物中含有一种相同类型的化学键 | |
| D. | 这几种元素可能形成的简单离子中E的简单离子的还原性最强 |
 据报道,一定条件下 Fe2O3可被甲烷还原为“纳米级”的金属铁.其反应为:Fe2O3(s)+3CH4(g)?2Fe(s)+3CO(g)+6H2(g)
据报道,一定条件下 Fe2O3可被甲烷还原为“纳米级”的金属铁.其反应为:Fe2O3(s)+3CH4(g)?2Fe(s)+3CO(g)+6H2(g)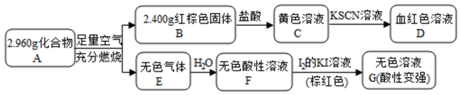
 . 该反应的离子方程式为Fe3S4+6H+=3Fe2++S+3H2S↑.
. 该反应的离子方程式为Fe3S4+6H+=3Fe2++S+3H2S↑.