题目内容
11.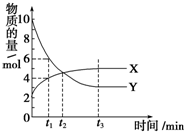 一定温度下在2L密闭容器内进行着某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如图.下列叙述中正确的是( )
一定温度下在2L密闭容器内进行着某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如图.下列叙述中正确的是( )| A. | 反应的化学方程式为3X(g)?7Y(g) | |
| B. | t1时,Y的浓度是X浓度的1.5倍 | |
| C. | t2时,正、逆反应速率相等 | |
| D. | 0到t1时间段内,Y的平均反应速率为4/t1 mol•L-1•min-1 |
分析 A.根据X、Y的物质的量变化判断反应物、生成物,然后根据t1时二者的变化量计算出其计量数;
B.t1时X的物质的量为4mol,Y的物质的量为6mol,然后根据c=$\frac{n}{V}$计算出二者浓度之比;
C.t2之后X、Y的浓度继续发生变化,说明此时没有达到平衡状态;
D.根据v=$\frac{\frac{△n}{V}}{△t}$计算出0到t1时间段内Y的平均反应速率.
解答 解:A.t1时X的物质的量增大了:4mol-2mol=2mol,Y的物质的量减小了:10mol-6mol=4mol,则X为生成物、Y为反应物,Y、X的计量数之比为:4mol:2mol=2:1,所以该反应的化学方程式为:2Y(g)?X(g),故A错误;
B.根据图示可知,t1时X的物质的量为4mol,Y的物质的量为6mol,由于容积相同,则二者的浓度之比等于其物质的量之比,所以Y的浓度是X浓度的$\frac{6mol}{4mol}$=1.5倍,故B正确;
C.t2之后X的浓度进行增大、Y的浓度继续减小,说明平衡仍然向着正向移动,则正反应速率大于逆反应速率,故C错误;
D.0到t1时间段内,Y的物质的量变化为4mol,则Y平均反应速率为:v(Y)=$\frac{\frac{4mol}{2L}}{{t}_{1}min}$=$\frac{2}{{t}_{1}}$mol•L-1•min-1,故D错误;
故选B.
点评 本题考查了化学平衡的计算,题目难度中等,明确图象曲线变化的含义为解答关键,注意掌握化学反应速率、物质的量浓度的概念及表达式,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
1.下列说法正确的是( )
| A. | 合成硫酸的工业尾气可以直接排入大气 | |
| B. | 进入接触室的气体,必须先经净化、干燥 | |
| C. | 从沸腾炉中排出的炉渣可以作为肥料 | |
| D. | 在高温、高压下由SO2和O2合成SO3 |
2.表是元素周期表的一部分,X、Y、Z、W均为短周期元素,X、Z的质子数之和为21.下列说法正确的是( )
| X | Y | ||
| Z | W |
| A. | X元素不能形成氧化物 | |
| B. | Y元素的最高价氧化物的水化物是含氧酸中酸性最强的 | |
| C. | X元素的非金属性比Y元素非金属性强 | |
| D. | 四种元素中,原子半径最小的元素是Y |
19.已知钍${\;}_{90}^{232}$Th的原子可发生下列放射性变化:${\;}_{90}^{232}$Th→${\;}_{88}^{228}$X+${\;}_{2}^{4}$He,生成的X是与Mg同主族的一种元素的原子,下列对X的推断错误的是( )
| A. | X的氢氧化物是一种强碱 | B. | X元素位于第六周期 | ||
| C. | X的碳酸盐难溶于水 | D. | X的最高化合价为+2价 |
6.下列说法不正确的是( )
| A. | SO2能与H2O2反应生成H2SO4 | |
| B. | 利用Cl2与石灰乳反应可以制取漂白粉 | |
| C. | Cl2能使紫色石蕊试液先变红后褪色 | |
| D. | 红热的铁丝能在Cl2中剧烈燃烧产生大量的白烟 |
16.工业上制备硫酸常用接触法,工业上制硝酸常用氨的催化氧化法.下列关于工业上制硫酸与硝酸的说法中不正确的是( )
| A. | 在沸腾炉中进行的反应为:4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2 | |
| B. | 制硫酸在吸收塔中是用水来吸收SO3 | |
| C. | 氨催化氧化制硝酸过程中的三个主要反应都属于氧化还原反应 | |
| D. | 硫酸工业、硝酸工业都需要对工业尾气进行处理 |
3.下列叙述正确的是( )
| A. | 同一周期元素的原子,半径越小越容易失去电子 | |
| B. | 元素的性质呈周期性变化的根本原因是核外电子排布呈周期性变化 | |
| C. | 第IA族元素与第VIIA族元素形成的化合物都是离子化合物 | |
| D. | 元素周期表中所有元素都是从自然界中发现的,过渡元素都是金属元素 |
20.某元素的离子的结构示意图与Mg2+相同,则下列说法正确的是( )
| A. | 该元素一定在第三周期 | |
| B. | 该元素一定在第二周期 | |
| C. | 若该离子是阳离子,则该元素一定在第三周期 | |
| D. | 若该离子是阴离子,则该元素一定在第三周期 |
1.对于合成氨反应N2(g)+3H2(g)?2NH3(g)△H<0;,下列反应速率关系中,正确的是( )
| A. | 3 v (N2)=v(H2) | B. | v (N2)=3v(H2) | C. | 1.5v (H2)=v(NH3) | D. | v (N2)=2v(NH3) |