题目内容
20.某元素的离子的结构示意图与Mg2+相同,则下列说法正确的是( )| A. | 该元素一定在第三周期 | |
| B. | 该元素一定在第二周期 | |
| C. | 若该离子是阳离子,则该元素一定在第三周期 | |
| D. | 若该离子是阴离子,则该元素一定在第三周期 |
分析 结构示意图与Mg2+相同,若该离子是阳离子,则该元素一定在第三周期,若该离子是阴离子,则该元素一定在第二周期,由此分析解答.
解答 解:A、不一定在第三周期,如第二周期的氟离子,故A错误;
B、不一定在第二周期,如第三周期的钠离子,故B错误;
C、若该离子是阳离子,则该元素一定在第三周期,故C正确;
D、若该离子是阴离子,则该元素一定在第二周期,故D错误;
故选C.
点评 本题考查电子层结构相同,包括两个方面,电子层数和每层上的电子数都相同这是解题的关键,比较容易.

练习册系列答案
相关题目
11.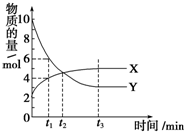 一定温度下在2L密闭容器内进行着某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如图.下列叙述中正确的是( )
一定温度下在2L密闭容器内进行着某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如图.下列叙述中正确的是( )
 一定温度下在2L密闭容器内进行着某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如图.下列叙述中正确的是( )
一定温度下在2L密闭容器内进行着某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如图.下列叙述中正确的是( )| A. | 反应的化学方程式为3X(g)?7Y(g) | |
| B. | t1时,Y的浓度是X浓度的1.5倍 | |
| C. | t2时,正、逆反应速率相等 | |
| D. | 0到t1时间段内,Y的平均反应速率为4/t1 mol•L-1•min-1 |
8.短周期主族元素X、Y、Z、W原子序数依次增大,X原子最外层有6个电子,Y是至今发现的非金属性最强的元素,Z在周期表中处于周期序数等于族序数的位置,W的单质广泛用作半导体材料.下列叙述不正确的是( )
| A. | 原子最外层电子数:Y>X>W>Z | B. | 原子半径:Z>W>X>Y | ||
| C. | 电负性:Y>X>W>Z | D. | 简单气态氢化物的沸点:Y>X |
15.表为元素周期表的一部分,用元素符号或化学用语回答下列问题.
(1)10种元素中,化学性质最不活泼的是Ar,除⑩外原子半径最大的是K
(2)①、②、④、⑧四种元素形成的离子半径由大到小的顺序为Cl->K+>Na+>Al3+,
(3)⑥和高价态的⑤形成的化合物的电子式是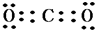 ,①、⑥两种元素能形成含共价键的离子化合物,该化合物的电子式为
,①、⑥两种元素能形成含共价键的离子化合物,该化合物的电子式为 ;用电子式表示元素③和⑨形成化合物的过程
;用电子式表示元素③和⑨形成化合物的过程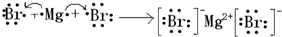
(4)⑥、⑦两种元素形成的简单氢化物中,沸点高的是H2O,原因是水分子之间存在氢键
(5)④和⑧两种元素最高价氧化物对应水化物相互反应的离子方程式3H++Al(OH)3=3H2O+Al3+
(6)写出一个能表示⑦、⑧两种元素非金属性强弱关系的化学方程式H2S+Cl2=2HCl+S↓,
(7)下列叙述中,肯定a金属比b金属活泼性强的是D(填序号)
A.a原子的最外层电子数比b原子的最外层电子数少
B.a原子的电子层数比b原子的电子层数多
C.1mol a 从酸中置换H+生成的H2比1mol b从酸中置换H+生成的H2多
D.常温时,a能从水中置换出氢,而b不能.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑤ | ⑥ | ||||||
| 3 | ① | ③ | ④ | ⑦ | ⑧ | ⑩ | ||
| 4 | ② | ⑨ |
(2)①、②、④、⑧四种元素形成的离子半径由大到小的顺序为Cl->K+>Na+>Al3+,
(3)⑥和高价态的⑤形成的化合物的电子式是
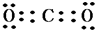 ,①、⑥两种元素能形成含共价键的离子化合物,该化合物的电子式为
,①、⑥两种元素能形成含共价键的离子化合物,该化合物的电子式为 ;用电子式表示元素③和⑨形成化合物的过程
;用电子式表示元素③和⑨形成化合物的过程
(4)⑥、⑦两种元素形成的简单氢化物中,沸点高的是H2O,原因是水分子之间存在氢键
(5)④和⑧两种元素最高价氧化物对应水化物相互反应的离子方程式3H++Al(OH)3=3H2O+Al3+
(6)写出一个能表示⑦、⑧两种元素非金属性强弱关系的化学方程式H2S+Cl2=2HCl+S↓,
(7)下列叙述中,肯定a金属比b金属活泼性强的是D(填序号)
A.a原子的最外层电子数比b原子的最外层电子数少
B.a原子的电子层数比b原子的电子层数多
C.1mol a 从酸中置换H+生成的H2比1mol b从酸中置换H+生成的H2多
D.常温时,a能从水中置换出氢,而b不能.
5.制造太阳能电池需要高纯度的硅,工业上制高纯度的硅常用以下化学反应实现:
①Si(s)+3HCl(g)$\frac{\underline{\;3000℃\;}}{\;}$SiHCl3(g)+H2(g)(放热反应)
②SiHCl3(g)+H2(g)$\frac{\underline{\;950℃\;}}{\;}$Si(s)+3HCl(g)
以下是对上述两个化学反应的叙述,其中错误的是( )
①Si(s)+3HCl(g)$\frac{\underline{\;3000℃\;}}{\;}$SiHCl3(g)+H2(g)(放热反应)
②SiHCl3(g)+H2(g)$\frac{\underline{\;950℃\;}}{\;}$Si(s)+3HCl(g)
以下是对上述两个化学反应的叙述,其中错误的是( )
| A. | 两个反应都是置换反应 | |
| B. | 反应②是放热反应 | |
| C. | 两个反应都有化学能与热能之间的转化 | |
| D. | 两个反应都是氧化还原反应 |
12.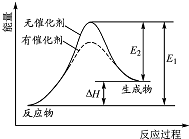 某反应的反应过程中能量变化如图所示(图中E1 表示正反应的活化能,E2 表示逆反应的活化能).下列有关叙述正确的是( )
某反应的反应过程中能量变化如图所示(图中E1 表示正反应的活化能,E2 表示逆反应的活化能).下列有关叙述正确的是( )
 某反应的反应过程中能量变化如图所示(图中E1 表示正反应的活化能,E2 表示逆反应的活化能).下列有关叙述正确的是( )
某反应的反应过程中能量变化如图所示(图中E1 表示正反应的活化能,E2 表示逆反应的活化能).下列有关叙述正确的是( )| A. | 催化剂能改变该反应的焓变 | B. | 催化剂能降低该反应的活化能 | ||
| C. | 该反应为放热反应 | D. | E1 越大,表明该反应越容易发生 |
10.某溶液中可能含有下列6种离子中的某几种:Cl-、SO42-、CO32-、NH4+、Na+、K+.为了确认溶液的组成,进行了如下实验:
①取200ml,上述溶液,加入足量BaCl2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.30g.向沉淀中加入过量的盐酸,有2.33g沉淀不溶.
②向①的滤液中加入足量的NaOH溶液,加热,产生能促使湿润的红色石蕊试纸变蓝的气体1.12L(已换算成标准状况,假定产生的气体全部逸出).关于原溶液组成的结论,不正确的是( )
①取200ml,上述溶液,加入足量BaCl2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.30g.向沉淀中加入过量的盐酸,有2.33g沉淀不溶.
②向①的滤液中加入足量的NaOH溶液,加热,产生能促使湿润的红色石蕊试纸变蓝的气体1.12L(已换算成标准状况,假定产生的气体全部逸出).关于原溶液组成的结论,不正确的是( )
| A. | C(NH4+)>C(SO42-) | |
| B. | 一定存在Cl-、SO42-、CO32-、NH4+,一定不存在Na+、K+ | |
| C. | c(CO32-)=0.05mol/L | |
| D. | 至少存在四种离子,且C(Cl-)≥0.05mol/L |