题目内容
1.对于合成氨反应N2(g)+3H2(g)?2NH3(g)△H<0;,下列反应速率关系中,正确的是( )| A. | 3 v (N2)=v(H2) | B. | v (N2)=3v(H2) | C. | 1.5v (H2)=v(NH3) | D. | v (N2)=2v(NH3) |
分析 不同物质表示的速率之比等于其化学计量数之比.
解答 解:不同物质表示的速率之比等于其化学计量数之比,
对于合成氨反应N2(g)+3H2(g)?2NH3(g),
A.v (N2):v(H2)=1:3,则3v (N2)=v(H2),故A正确;
B.v (N2):v(H2)=1:3,则3v (N2)=v(H2),故B错误;
C.v (H2):v(NH3)=3:2,则v (H2)=1.5v(NH3),故C错误;
D.v (N2):v(NH3)=1:2,则2v (N2)=v(NH3),故D错误,
故选:A.
点评 本题考查化学反应速率与化学计量数关系,注意根据速率公式定义式理解速率规律,比较基础.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
11.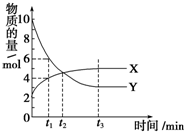 一定温度下在2L密闭容器内进行着某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如图.下列叙述中正确的是( )
一定温度下在2L密闭容器内进行着某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如图.下列叙述中正确的是( )
 一定温度下在2L密闭容器内进行着某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如图.下列叙述中正确的是( )
一定温度下在2L密闭容器内进行着某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如图.下列叙述中正确的是( )| A. | 反应的化学方程式为3X(g)?7Y(g) | |
| B. | t1时,Y的浓度是X浓度的1.5倍 | |
| C. | t2时,正、逆反应速率相等 | |
| D. | 0到t1时间段内,Y的平均反应速率为4/t1 mol•L-1•min-1 |
12.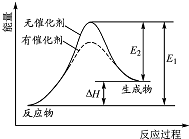 某反应的反应过程中能量变化如图所示(图中E1 表示正反应的活化能,E2 表示逆反应的活化能).下列有关叙述正确的是( )
某反应的反应过程中能量变化如图所示(图中E1 表示正反应的活化能,E2 表示逆反应的活化能).下列有关叙述正确的是( )
 某反应的反应过程中能量变化如图所示(图中E1 表示正反应的活化能,E2 表示逆反应的活化能).下列有关叙述正确的是( )
某反应的反应过程中能量变化如图所示(图中E1 表示正反应的活化能,E2 表示逆反应的活化能).下列有关叙述正确的是( )| A. | 催化剂能改变该反应的焓变 | B. | 催化剂能降低该反应的活化能 | ||
| C. | 该反应为放热反应 | D. | E1 越大,表明该反应越容易发生 |
16.下列电离方程式正确的是( )
| A. | H2S?2H++S2- | B. | NaHSO4?Na ++HSO4- | ||
| C. | NaHCO3?Na++H++CO32- | D. | HCO3-+H2O?CO32-+H3O+ |
13.下表为六种短周期元素的部分性质,下列有关说法错误的是( )
| 元素代号 | X | Y | Z | Q | R | T |
| 原子半径/10-10m | 0.77 | 0.66 | 0.70 | 1.17 | 0.99 | 1.10 |
| 主要化合价 | +4、-4 | -2 | +5、-3 | +4、-4 | +7、-1 | +5、-3 |
| A. | X与Y可以形成阴离子XY32- | |
| B. | 元素R的氧化物对应水化物一定为强酸 | |
| C. | Z的氢化物的沸点比T的氢化物的沸点高 | |
| D. | 由X形成的化合物QX和XR4,其晶体类型不相同 |
10.某溶液中可能含有下列6种离子中的某几种:Cl-、SO42-、CO32-、NH4+、Na+、K+.为了确认溶液的组成,进行了如下实验:
①取200ml,上述溶液,加入足量BaCl2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.30g.向沉淀中加入过量的盐酸,有2.33g沉淀不溶.
②向①的滤液中加入足量的NaOH溶液,加热,产生能促使湿润的红色石蕊试纸变蓝的气体1.12L(已换算成标准状况,假定产生的气体全部逸出).关于原溶液组成的结论,不正确的是( )
①取200ml,上述溶液,加入足量BaCl2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.30g.向沉淀中加入过量的盐酸,有2.33g沉淀不溶.
②向①的滤液中加入足量的NaOH溶液,加热,产生能促使湿润的红色石蕊试纸变蓝的气体1.12L(已换算成标准状况,假定产生的气体全部逸出).关于原溶液组成的结论,不正确的是( )
| A. | C(NH4+)>C(SO42-) | |
| B. | 一定存在Cl-、SO42-、CO32-、NH4+,一定不存在Na+、K+ | |
| C. | c(CO32-)=0.05mol/L | |
| D. | 至少存在四种离子,且C(Cl-)≥0.05mol/L |
11.下列反应中,SO2属于氧化剂的是( )
| A. | SO2+H2O═H2SO3 | B. | SO2+2NaOH═Na2SO3+H2O | ||
| C. | 2SO2+O2$\frac{\underline{\;V_{2}O_{5}\;}}{△}$2SO3 | D. | SO2+2H2S═3S↓+2H2O |
