题目内容
16.工业上制备硫酸常用接触法,工业上制硝酸常用氨的催化氧化法.下列关于工业上制硫酸与硝酸的说法中不正确的是( )| A. | 在沸腾炉中进行的反应为:4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2 | |
| B. | 制硫酸在吸收塔中是用水来吸收SO3 | |
| C. | 氨催化氧化制硝酸过程中的三个主要反应都属于氧化还原反应 | |
| D. | 硫酸工业、硝酸工业都需要对工业尾气进行处理 |
分析 A.根据工业上制备硫酸常用接触法,制硫酸的原料为硫铁矿、空气和98.3%的硫酸等,在沸腾炉在、接触室中进行的反应分析;
B.直接用水吸收SO3,易形成酸雾,降低吸收效;
C.氨催化氧化制硝酸过程中的三个主要反应,根据氮元素化合价的升降来判断是否是氧化还原反应;
D.工业制硫酸、硝酸,会生成二氧化硫、三氧化硫、一氧化氮、二氧化氮等酸性气体,而且这些气体都有毒,需对其进行尾气处理.
解答 解:A.在沸腾炉中进行的反应为4FeS2+11O2 $\frac{\underline{\;高温\;}}{\;}$ 2Fe2O3+8SO2,在接触室中进行的反应为2SO2+O2 $?_{△}^{催化剂}$ 2SO3,故A正确;
B.在吸收塔中,直接用水吸收SO3,易形成酸雾,降低SO3吸收效率,应用98.3%硫酸吸收SO3,故B错误;
C.工业上制硝酸是用氨的催化氧化法,过程中有三个主要反应:4NH3+5O2 $\frac{\underline{催化剂}}{△}$ 4NO+6H2O,2NO+O2 ═2NO2 ,3NO2+H2O═2HNO3+NO,NH3~NO~NO2~HNO3 ,氮元素的化合价改变,所以三个反应都是氧化还原反应,故C正确;
D.工业制硫酸、硝酸,会生成二氧化硫、三氧化硫、一氧化氮、二氧化氮等酸性气体,而且这些气体都有毒,需对其进行尾气处理,故D正确;
故选B.
点评 本题考查了硫酸工业、硝酸工业的有关问题,涉及环境保护,三氧化硫的吸收,题目难度不大,注意掌握生产硫酸的原理及流程.

练习册系列答案
相关题目
6.工业上采用接触法制硫酸,其中在接触室进行的反应是( )
| A. | S+O2 $\frac{\underline{\;\;△\;\;}}{\;}$ SO2 | B. | 4FeS2+11O2 $\frac{\underline{\;高温\;}}{\;}$ 2Fe2O3+8SO2 | ||
| C. | 2SO2+O2 $?_{加热}^{催化剂}$ 2SO3 | D. | SO3+H2O=H2SO4 |
7.下列有关方程式描述中,反应类型与其它三个反应不同的是( )
| A. | 2CH3CH2OH+O2$→_{△}^{催化剂}$2CH3CHO+2H2O | |
| B. | 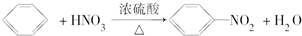 | |
| C. | CH3CH2OH+CH3COOH$→_{△}^{催化剂}$CH3COOC2H5+H2O | |
| D. | CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl |
4.下列反应中,既是氧化还原反应又是吸热反应的是( )
| A. | 氯化铵与氢氧化钡晶体反应 | B. | 灼热的碳和水蒸气反应 | ||
| C. | 碳酸钙分解反应 | D. | Na和水反应 |
11.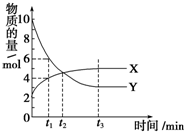 一定温度下在2L密闭容器内进行着某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如图.下列叙述中正确的是( )
一定温度下在2L密闭容器内进行着某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如图.下列叙述中正确的是( )
 一定温度下在2L密闭容器内进行着某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如图.下列叙述中正确的是( )
一定温度下在2L密闭容器内进行着某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如图.下列叙述中正确的是( )| A. | 反应的化学方程式为3X(g)?7Y(g) | |
| B. | t1时,Y的浓度是X浓度的1.5倍 | |
| C. | t2时,正、逆反应速率相等 | |
| D. | 0到t1时间段内,Y的平均反应速率为4/t1 mol•L-1•min-1 |
1.下列各组物质发生变化时,所克服的微粒间作用力属于同种类型的是( )
| A. | 二氧化硅和氢氧化钠的熔化 | B. | 碘和干冰的升华 | ||
| C. | 氯化氢和氯化钠的溶解 | D. | 汞和硫的气化 |
8.短周期主族元素X、Y、Z、W原子序数依次增大,X原子最外层有6个电子,Y是至今发现的非金属性最强的元素,Z在周期表中处于周期序数等于族序数的位置,W的单质广泛用作半导体材料.下列叙述不正确的是( )
| A. | 原子最外层电子数:Y>X>W>Z | B. | 原子半径:Z>W>X>Y | ||
| C. | 电负性:Y>X>W>Z | D. | 简单气态氢化物的沸点:Y>X |
5.制造太阳能电池需要高纯度的硅,工业上制高纯度的硅常用以下化学反应实现:
①Si(s)+3HCl(g)$\frac{\underline{\;3000℃\;}}{\;}$SiHCl3(g)+H2(g)(放热反应)
②SiHCl3(g)+H2(g)$\frac{\underline{\;950℃\;}}{\;}$Si(s)+3HCl(g)
以下是对上述两个化学反应的叙述,其中错误的是( )
①Si(s)+3HCl(g)$\frac{\underline{\;3000℃\;}}{\;}$SiHCl3(g)+H2(g)(放热反应)
②SiHCl3(g)+H2(g)$\frac{\underline{\;950℃\;}}{\;}$Si(s)+3HCl(g)
以下是对上述两个化学反应的叙述,其中错误的是( )
| A. | 两个反应都是置换反应 | |
| B. | 反应②是放热反应 | |
| C. | 两个反应都有化学能与热能之间的转化 | |
| D. | 两个反应都是氧化还原反应 |
