题目内容
19.已知钍${\;}_{90}^{232}$Th的原子可发生下列放射性变化:${\;}_{90}^{232}$Th→${\;}_{88}^{228}$X+${\;}_{2}^{4}$He,生成的X是与Mg同主族的一种元素的原子,下列对X的推断错误的是( )| A. | X的氢氧化物是一种强碱 | B. | X元素位于第六周期 | ||
| C. | X的碳酸盐难溶于水 | D. | X的最高化合价为+2价 |
分析 生成的X是与Mg同主族的一种元素的原子,根据元素周期律,同主族元素具有相似性和递变性的规律进行分析.
解答 解:A、X是与Mg同主族的一种元素的原子,同一主族元素,金属性随着原子序数的增大而增强,金属性越强,其相应的碱的碱性越强,x的金属性大于它前边的金属(同一主族的金属),所以x的氢氧化物的碱性大于它前边的金属的氢氧化物(同一主族的金属),氢氧化钡是强碱,所以X的氢氧化物是一种强碱,故A正确;
B、X原子核外有7个电子层,X元素位于第七周期,故B错误;
C、根据元素周期律,同一主族元素及其化合物具有相似性,第二主族元素的碳酸镁、碳酸钡不溶于水,所以X的碳酸正盐难溶于水,故C正确;
D、主族元素的最高化合价与其族序数相等,x、Mg属第二主族的元素,最高化合价为+2价,故D正确;
故选:B.
点评 本题考查的是元素周期律的应用,根据已知元素的性质推测未知元素的性质,通过元素周期律比较即可.

练习册系列答案
相关题目
12.0.9molFe2O3与一定量CO反应后得到固体X,将X溶于足量稀盐酸,再通入0.5molCl2,恰好氧化完全.则X的组成及物质的量之比可能是( )
| A. | 2:3混合的Fe3O4与FeO | B. | 3:5:4混合的Fe3O4、FeO与Fe | ||
| C. | 4:5混合的Fe2O3和FeO | D. | 1:1:4混合的Fe2O3、Fe3O4与FeO |
7.下列有关方程式描述中,反应类型与其它三个反应不同的是( )
| A. | 2CH3CH2OH+O2$→_{△}^{催化剂}$2CH3CHO+2H2O | |
| B. | 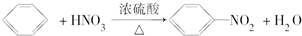 | |
| C. | CH3CH2OH+CH3COOH$→_{△}^{催化剂}$CH3COOC2H5+H2O | |
| D. | CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl |
14.下列有关化学用语表示正确的是( )
| A. | 中子数为20的氯原子:${\;}_{17}^{20}$Cl | B. | N2的电子式: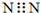 | ||
| C. | 硫离子结构示意图: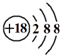 | D. | CH4分子的比例模型: |
4.下列反应中,既是氧化还原反应又是吸热反应的是( )
| A. | 氯化铵与氢氧化钡晶体反应 | B. | 灼热的碳和水蒸气反应 | ||
| C. | 碳酸钙分解反应 | D. | Na和水反应 |
11.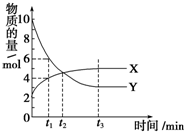 一定温度下在2L密闭容器内进行着某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如图.下列叙述中正确的是( )
一定温度下在2L密闭容器内进行着某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如图.下列叙述中正确的是( )
 一定温度下在2L密闭容器内进行着某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如图.下列叙述中正确的是( )
一定温度下在2L密闭容器内进行着某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如图.下列叙述中正确的是( )| A. | 反应的化学方程式为3X(g)?7Y(g) | |
| B. | t1时,Y的浓度是X浓度的1.5倍 | |
| C. | t2时,正、逆反应速率相等 | |
| D. | 0到t1时间段内,Y的平均反应速率为4/t1 mol•L-1•min-1 |
8.短周期主族元素X、Y、Z、W原子序数依次增大,X原子最外层有6个电子,Y是至今发现的非金属性最强的元素,Z在周期表中处于周期序数等于族序数的位置,W的单质广泛用作半导体材料.下列叙述不正确的是( )
| A. | 原子最外层电子数:Y>X>W>Z | B. | 原子半径:Z>W>X>Y | ||
| C. | 电负性:Y>X>W>Z | D. | 简单气态氢化物的沸点:Y>X |