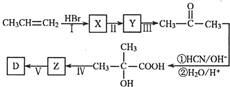
题目内容
6.下列说法不正确的是( )| A. | SO2能与H2O2反应生成H2SO4 | |
| B. | 利用Cl2与石灰乳反应可以制取漂白粉 | |
| C. | Cl2能使紫色石蕊试液先变红后褪色 | |
| D. | 红热的铁丝能在Cl2中剧烈燃烧产生大量的白烟 |
分析 A、二氧化硫具有还原性,而过氧化氢具有还原性;
B、利用Cl2与石灰乳反应生成氯化钙和次氯酸钙;
C、新制氯水中含有盐酸和次氯酸;
D、反应生成氯化铁;
解答 解:A、二氧化硫具有还原性,而过氧化氢具有还原性,两者发生氧化还原反应生成硫酸,故A正确;
B、利用Cl2与石灰乳反应生成氯化钙和次氯酸钙,所以可以用Cl2与石灰乳反应可以制取漂白粉,故B正确;
C、新制氯水中含有盐酸和次氯酸,盐酸可使石蕊试液变红,次氯酸具有漂白性,可使试液褪色,故C正确;
D、反应生成氯化铁,则观察到棕黄色的烟,而不是白烟,故D错误;
故选D.
点评 本题考查氧化还原反应,为高频考点,涉及氧化还原反应基本概念、漂白性等,综合性较强,注意性质与用途的关系,题目难度不大.

练习册系列答案
相关题目
19.适当温度下电解H2O-CO2混合气体可制得H2和CO,其电解原理如图所示,下列说法正确的是( )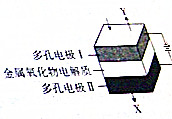

| A. | X的成分是H2和CO | |
| B. | 阳极的电极反应式为2O2--4e-=O2↑ | |
| C. | 电解质中的O2-移向电极I | |
| D. | 当阴极上有2mol气体生成时,通过电解质的电子数目为4NA |
14.下列有关化学用语表示正确的是( )
| A. | 中子数为20的氯原子:${\;}_{17}^{20}$Cl | B. | N2的电子式: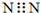 | ||
| C. | 硫离子结构示意图: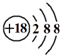 | D. | CH4分子的比例模型: |
1.能正确表示下列化学反应的离子方程式是( )
| A. | 碳酸钙与醋酸反应:CaCO3+2H+=Ca2++CO2↑+H2O | |
| B. | 氯气溶于水:Cl2+H2O?2H++Cl一+ClO一 | |
| C. | 过量二氧化碳与石灰水反应:CO2+2OH一=CO32一+H2O | |
| D. | 利用腐蚀法制作印刷线路板:2Fe3++Cu=2Fe2++Cu2+ |
11.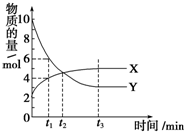 一定温度下在2L密闭容器内进行着某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如图.下列叙述中正确的是( )
一定温度下在2L密闭容器内进行着某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如图.下列叙述中正确的是( )
 一定温度下在2L密闭容器内进行着某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如图.下列叙述中正确的是( )
一定温度下在2L密闭容器内进行着某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如图.下列叙述中正确的是( )| A. | 反应的化学方程式为3X(g)?7Y(g) | |
| B. | t1时,Y的浓度是X浓度的1.5倍 | |
| C. | t2时,正、逆反应速率相等 | |
| D. | 0到t1时间段内,Y的平均反应速率为4/t1 mol•L-1•min-1 |
18.通过14C标记的C60进行跟踪研究,医学界发现了一种C60的羧酸衍生物在特定的条件下可通过断裂DNA杀死艾滋病病毒.有关C60和14C的叙述正确的是( )
| A. | 12C60与14C60互为同位素 | |
| B. | 14C转变为12C的过程属于化学变化 | |
| C. | 12C与14C的原子中含有的中子数之比为3:4 | |
| D. | 金刚石与C60都属于原子晶体 |
15.表为元素周期表的一部分,用元素符号或化学用语回答下列问题.
(1)10种元素中,化学性质最不活泼的是Ar,除⑩外原子半径最大的是K
(2)①、②、④、⑧四种元素形成的离子半径由大到小的顺序为Cl->K+>Na+>Al3+,
(3)⑥和高价态的⑤形成的化合物的电子式是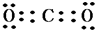 ,①、⑥两种元素能形成含共价键的离子化合物,该化合物的电子式为
,①、⑥两种元素能形成含共价键的离子化合物,该化合物的电子式为 ;用电子式表示元素③和⑨形成化合物的过程
;用电子式表示元素③和⑨形成化合物的过程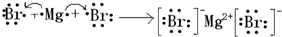
(4)⑥、⑦两种元素形成的简单氢化物中,沸点高的是H2O,原因是水分子之间存在氢键
(5)④和⑧两种元素最高价氧化物对应水化物相互反应的离子方程式3H++Al(OH)3=3H2O+Al3+
(6)写出一个能表示⑦、⑧两种元素非金属性强弱关系的化学方程式H2S+Cl2=2HCl+S↓,
(7)下列叙述中,肯定a金属比b金属活泼性强的是D(填序号)
A.a原子的最外层电子数比b原子的最外层电子数少
B.a原子的电子层数比b原子的电子层数多
C.1mol a 从酸中置换H+生成的H2比1mol b从酸中置换H+生成的H2多
D.常温时,a能从水中置换出氢,而b不能.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑤ | ⑥ | ||||||
| 3 | ① | ③ | ④ | ⑦ | ⑧ | ⑩ | ||
| 4 | ② | ⑨ |
(2)①、②、④、⑧四种元素形成的离子半径由大到小的顺序为Cl->K+>Na+>Al3+,
(3)⑥和高价态的⑤形成的化合物的电子式是
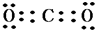 ,①、⑥两种元素能形成含共价键的离子化合物,该化合物的电子式为
,①、⑥两种元素能形成含共价键的离子化合物,该化合物的电子式为 ;用电子式表示元素③和⑨形成化合物的过程
;用电子式表示元素③和⑨形成化合物的过程
(4)⑥、⑦两种元素形成的简单氢化物中,沸点高的是H2O,原因是水分子之间存在氢键
(5)④和⑧两种元素最高价氧化物对应水化物相互反应的离子方程式3H++Al(OH)3=3H2O+Al3+
(6)写出一个能表示⑦、⑧两种元素非金属性强弱关系的化学方程式H2S+Cl2=2HCl+S↓,
(7)下列叙述中,肯定a金属比b金属活泼性强的是D(填序号)
A.a原子的最外层电子数比b原子的最外层电子数少
B.a原子的电子层数比b原子的电子层数多
C.1mol a 从酸中置换H+生成的H2比1mol b从酸中置换H+生成的H2多
D.常温时,a能从水中置换出氢,而b不能.
16.下列电离方程式正确的是( )
| A. | H2S?2H++S2- | B. | NaHSO4?Na ++HSO4- | ||
| C. | NaHCO3?Na++H++CO32- | D. | HCO3-+H2O?CO32-+H3O+ |
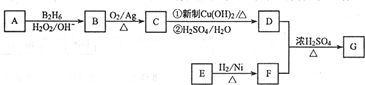
 .
. .
.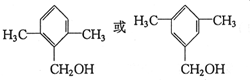 (写出一种即可).
(写出一种即可).