题目内容
15.下列物质中既有离子键又有共价键的是( )| A. | CaO | B. | CO2 | C. | K2O | D. | Ca(OH )2 |
分析 一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,第IA族、第IIA族和第VIA族、第VIIA族之间易形成离子键.
解答 解:A.CaO中钙离子和氧离子之间只存在离子键,故A错误;
B.二氧化碳中C原子和O原子之间只存在共价键,故B错误;
C.氧化钾中钾离子和氧离子之间只存在离子键,故C错误;
D.氢氧化钙中钙离子和氢氧根离子之间存在离子键、O原子和H原子之间存在共价键,故D正确;
故选D.
点评 本题考查了化学键的判断,根据物质的构成微粒及微粒间的作用力来分析解答,注意离子键和共价键的区别,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
6.在2L密闭容器中充入6molA气体和5molB气体,在一定条件下发生反应:3A(g)+B(g)?2C(g)+xD(g),2min达到平衡时,生成了2molC,经测定D的平均反应速率为0.5mol•L-1•min-1,下列判断不正确的是( )
| A. | x=1 | |
| B. | B的转化率为20% | |
| C. | 平衡时A的浓度为1.50mol/L | |
| D. | 达到平衡时,在相同温度下容器内混合气体的压强与反应前相等 |
3.用二甲醚燃料电池做电源,用惰性电极电解饱和K2SO4溶液可制取H2SO4和KOH,实验装置如图所示:

下列说法错误的是( )

下列说法错误的是( )
| A. | Y为KOH | |
| B. | A口导出的物质为H2SO4 | |
| C. | 二甲醚燃料电池的负极反应式为CH3OCH3+3H2O-12e-═2CO2+12H+ | |
| D. | 若燃料电池通入CH3OCH3(g)的速率为0.1mol/min,2min时,理论上C口收集到气体的体积为26.88L |
10.已知2mol H2(g)燃烧生成液态水放出的热量为571.6lkJ,而2molH2 (g)完全燃烧生成气态水放的热量为483.6kJ.下列说法正确的是( )
| A. | l molH2O (I)变成lmolH2O (g),向外界释放能量 | |
| B. | 1molH2O (g)分解成H2(g)和O2(g),吸收241. 8kJ能量 | |
| C. | 2mol H2(g)和l mol O2(g)的总能量小于2molH2O(1)的能量 | |
| D. | 断裂2molH2O (g)中所有的O-H键,吸收483.6 kJ能量 |
7.(1)氯碱工业是利用电解食盐水生产烧碱、氯气为基础的工业体系.
(2)电解前,为除去食盐水中的Mg2+、Ca2+、SO42-等杂质离子,下列加入顺序合理的是D.
A.碳酸钠、氢氧化钠、氯化钡B.碳酸钠、氯化钡、氢氧化钠
C.氢氧化钠、碳酸钠、氯化钡D.氯化钡、氢氧化钠、碳酸钠
(3)“盐泥”是粗盐提纯及电解食盐水过程中形成的工业“废料”.某工厂的盐泥组成如下:
为生产七水硫酸镁,设计了以下工艺流程:

生产七水硫酸镁工艺流程图
1-反应器 2-过滤器 3-蒸发浓缩器 4-结晶槽 5-洗涤槽 6-真空干燥器
装置1中加入的酸应选用硫酸,加入的酸应适当过量,控制pH为5左右,反应温度在50℃左右.持续搅拌使之充分反应,以使Mg(OH)2充分溶解并转化为MgSO4,在此过程中同时生成CaSO4.其中碳酸钙可以转化为硫酸钙的原因是使平衡CaCO3+H2SO4?CaSO4+H2CO3(H2O+CO2↑)不断向右移动.
装置2中滤渣的主要成分为CaSO4、BaSO4、其它不溶物质.
装置3中通入高温水蒸汽并控制温度在100~110℃,蒸发结晶,此时析出的晶体主要是NaCl.
用装置6(真空干燥器)干燥七水硫酸镁晶体的理由是防止失去结晶水.
(2)电解前,为除去食盐水中的Mg2+、Ca2+、SO42-等杂质离子,下列加入顺序合理的是D.
A.碳酸钠、氢氧化钠、氯化钡B.碳酸钠、氯化钡、氢氧化钠
C.氢氧化钠、碳酸钠、氯化钡D.氯化钡、氢氧化钠、碳酸钠
(3)“盐泥”是粗盐提纯及电解食盐水过程中形成的工业“废料”.某工厂的盐泥组成如下:
| 成分 | NaCl | Mg(OH)2 | CaCO3 | BaSO4 | 其他不溶于酸的物质 |
| 质量分数(%) | 15~20 | 15~20 | 5~10 | 30~40 | 10~15 |

生产七水硫酸镁工艺流程图
1-反应器 2-过滤器 3-蒸发浓缩器 4-结晶槽 5-洗涤槽 6-真空干燥器
装置1中加入的酸应选用硫酸,加入的酸应适当过量,控制pH为5左右,反应温度在50℃左右.持续搅拌使之充分反应,以使Mg(OH)2充分溶解并转化为MgSO4,在此过程中同时生成CaSO4.其中碳酸钙可以转化为硫酸钙的原因是使平衡CaCO3+H2SO4?CaSO4+H2CO3(H2O+CO2↑)不断向右移动.
装置2中滤渣的主要成分为CaSO4、BaSO4、其它不溶物质.
装置3中通入高温水蒸汽并控制温度在100~110℃,蒸发结晶,此时析出的晶体主要是NaCl.
用装置6(真空干燥器)干燥七水硫酸镁晶体的理由是防止失去结晶水.
5.已知2Fe3++2Br-=2Fe2++Br2,当把Cl2通入FeBr2溶液中时,下列离子方程式一定不正确的是( )
| A. | Cl2+2Br-=Br2+2Cl- | |
| B. | 4Cl2+6Br-+2Fe2+=2Fe3++3Br2+8Cl- | |
| C. | 3Cl2+2Fe2++4Br-=2Fe3++2Br2+6Cl- | |
| D. | 2Cl2+2Fe2++2Br-=2Fe3++Br2+4Cl- |
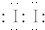 (用电子式表示).
(用电子式表示).
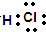 .
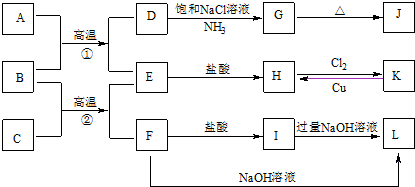
.
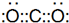 .
.