题目内容
3.用二甲醚燃料电池做电源,用惰性电极电解饱和K2SO4溶液可制取H2SO4和KOH,实验装置如图所示: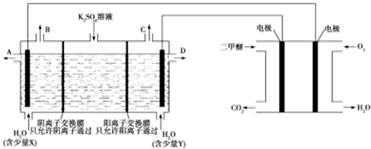
下列说法错误的是( )
| A. | Y为KOH | |
| B. | A口导出的物质为H2SO4 | |
| C. | 二甲醚燃料电池的负极反应式为CH3OCH3+3H2O-12e-═2CO2+12H+ | |
| D. | 若燃料电池通入CH3OCH3(g)的速率为0.1mol/min,2min时,理论上C口收集到气体的体积为26.88L |
分析 用二甲醚燃料电池做电源,用惰性电极电解饱和K2SO4溶液可制取H2SO4和KOH,根据电解原理,在电解池的阴极上产生氢气,得到氢氧化钾,在阳极上产生氧气,得到硫酸溶液,根据燃料电池和电解池的工作原理来回答.
解答 解:通入二甲醚的电极是原电池的负极,通入氧气的电极是原电池的正极,所以电解池的右端是阴极,电解池的左端是阳极,
A、在电解池的阴极产生的是氢气,即D处产生氢气,该电极附近碱性增强,Y为KOH,故A正确;
B、在电解池的阳极产生的是阳气,即A处产生氧气,该电极附近酸性增强,A口导出的物质为H2SO4,故B正确;
C、通入二甲醚的电极是原电池的负极,负极反应式为CH3OCH3+3H2O-12e-═2CO2+12H+,故C正确;
D、若燃料电池通入CH3OCH3(g)的速率为0.1mol/min,2min时CH3OCH3(g)的物质的量是0.2mol,根据负极反应式为CH3OCH3+3H2O-12e-═2CO2+12H+,转移电子是2.4mol,C口收集到气体是氢气,产生氢气是1.2mol,标况下的体积为1.2mol×22.4L/mol=26.88L,故D错误.
故选D.
点评 本题考查燃料电池和电解池的工作原理应用以及电极反应的书写和计算知识,注意知识的迁移应用是关键,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
13.二氧化碳的回收利用是环保领域研究的热点课题.
(1)在太阳能的作用下,以CO2为原料制取炭黑的流程如图1所示.其总反应的化学方程式为CO2$\frac{\underline{\;△或太阳能\;}}{FeO}$C+O2.

(2)CO2经过催化氢化合成低碳烯烃.其合成乙烯的反应为2C02(g)+6H2(g)?CH2=CH2(g)+4H20(g)△H,
几种物质的能量(在标准状况下,规定单质的能量为0,测得其他物质在生成时所放出或吸收的热量)如下表所示:
则△H=-128kJ/mol
(3)在2L恒容密闭容器中充入2molCO2和nmol H2,在一定条件下发生(2)中的反应,CO2的转化率与温度、投料比[X=$\frac{n({H}_{2})}{n(C{O}_{2})}$]的关系如图2所示.
①X1> X2(填“>”、“<”或“=”,下同),平衡常数KA> KB.
②若B点的投料比为3,且从反应开始到B点需要10min,则v(H2)=0.225mol/(L.min).
(4)以稀硫酸为电解质溶液,利用太阳能将CO2转化为低碳烯烃,工作原理图如图3.
①b电极的名称是正极.
②产生丙烯的电极反应式为3CO2+18H++18e-=CH3CH=CH2+6H2O.
(1)在太阳能的作用下,以CO2为原料制取炭黑的流程如图1所示.其总反应的化学方程式为CO2$\frac{\underline{\;△或太阳能\;}}{FeO}$C+O2.

(2)CO2经过催化氢化合成低碳烯烃.其合成乙烯的反应为2C02(g)+6H2(g)?CH2=CH2(g)+4H20(g)△H,
几种物质的能量(在标准状况下,规定单质的能量为0,测得其他物质在生成时所放出或吸收的热量)如下表所示:
| 物质 | H2(g) | CO2(g) | CH2=CH2(g) | H2O(g) |
| 能量/kJ•mol-1 | 0 | -394 | 52 | -242 |
(3)在2L恒容密闭容器中充入2molCO2和nmol H2,在一定条件下发生(2)中的反应,CO2的转化率与温度、投料比[X=$\frac{n({H}_{2})}{n(C{O}_{2})}$]的关系如图2所示.
①X1> X2(填“>”、“<”或“=”,下同),平衡常数KA> KB.
②若B点的投料比为3,且从反应开始到B点需要10min,则v(H2)=0.225mol/(L.min).
(4)以稀硫酸为电解质溶液,利用太阳能将CO2转化为低碳烯烃,工作原理图如图3.
①b电极的名称是正极.
②产生丙烯的电极反应式为3CO2+18H++18e-=CH3CH=CH2+6H2O.
14.下列说法正确的是( )
| A. | BaO2(过氧化钡)固体中的阴离子和阳离子之比为2:1 | |
| B. | 在SiO2晶体中,1个Si原子和2个O原子形成2个共价键 | |
| C. | HCl的相对分子质量大于HF,所以HCl的沸点高于HF | |
| D. | 由ⅠA族和ⅥA族元素可形成原子个数比为1:1、电子总数为38的化合物 |
11.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 1.0 mol•L-1 KNO3溶液:H+、Fe2+、SCN-、SO42- | |
| B. | 水电离出的c(H+)=10-10 mol•L-1的溶液:K+、Ba2+、NO3-、Cl- | |
| C. | pH=0的溶液:Al3+、Ag(NH3)2+、Cl-、SO42- | |
| D. | c(ClO-)=1.0 mol•L-1的溶液:Na+、SO32-、S2-、SO42- |
18.常温下,取0.3mol/L HY溶液与0.3mol/L NaOH溶液等体积混合(不计混合后溶液体积变化),测得混合溶液的pH=9,则下列说法(或关系式)正确的是( )
| A. | 混合溶液中由水电离出来的c(OH-)=1×10-9mol/L | |
| B. | c(OH-)-c(HY)=c(H+)=1×10-5mol/L | |
| C. | 混合溶液中c(Na+)=c(Y-)+c(HY)=0.15mol/L | |
| D. | 混合溶液中离子浓度大小次序为:c(Y-)>c(Na+)>c(OH-)>c(H+) |
8.下列有关氯气的说法正确的是( )
| A. | 氯气是黄绿色气体,有毒,有刺激性气味,氯水还可杀菌消毒 | |
| B. | 液氯就是氯气的水溶液,它能使干燥的有色布条褪色 | |
| C. | 红热的铁丝在Cl2中燃烧产生棕色的雾;H2在Cl2中燃烧火焰呈淡蓝色 | |
| D. | 氯水长时间放置会变质,是因为氯气几乎完全挥发,剩下的就是水. |
15.下列物质中既有离子键又有共价键的是( )
| A. | CaO | B. | CO2 | C. | K2O | D. | Ca(OH )2 |
12.下表列出了①~⑨九种元素在周期表中的位置:
请按要求回答下列问题.
(1)化学性质最不活泼的元素的原子结构示意图为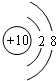
(2)⑥④⑦的氢化物的稳定性最强的是:H2O(写氢化物的化学式);
(3)元素③④⑤形成的离子半径由大到小的顺序是N3->O2->Na+(用离子符号表示)
(4)用电子式表示元素⑤与⑦的化合物的形成过程: .
.
| ⅠA | Ⅷ | ||||||
| ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| ② | ③ | ④ | ⑧ | ||||
| ⑤ | ⑥ | ⑦ | ⑨ | ||||
(1)化学性质最不活泼的元素的原子结构示意图为
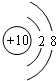
(2)⑥④⑦的氢化物的稳定性最强的是:H2O(写氢化物的化学式);
(3)元素③④⑤形成的离子半径由大到小的顺序是N3->O2->Na+(用离子符号表示)
(4)用电子式表示元素⑤与⑦的化合物的形成过程:
 .
.
13.用惰性电极电解一定浓度的CuSO4溶液,通电一段时间后,向所得的溶液中加入0.1mol 的CuO和0.1molH2O后恰好恢复到电解前的浓度,则电解过程中阳极产生的气体在标准状况下的体积为( )
| A. | 2.24L | B. | 3.36L | C. | 1.12L | D. | 4.48L |