题目内容
20.A一J是中学化学中常见的物质,其相互转化关系如图所示,反应条件均已略去.A、B常温下均为无色液体,且均由两种相同的元素组成;C、F、G均为非金属单质,常温下C、F为无色气体,G为黄绿色气体,D是应用最广泛的金属;J溶液中滴人KSCN溶液显红色.
请回答下列问题:
(1)A的化学式是H2O2.
(2)H的电子式是
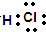 .
.(3)B→C+F的化学方程式是2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑.
(4)J+D→I的离子方程式是2Fe3++Fe=3Fe2+.
分析 A、B常温下均为无色液体,且均由两种相同的元素组成,A生成B和C,C为气体,一般为H2O2生成H2O的反应,则A为H2O2,B为H2O,C为O2,G为黄绿色气体,应为Cl2,D是应用最广泛的金属,应为Fe,由转化关系可知F为H2,H为HCl,E为Fe3O4,J为FeCl3,I为FeCl2,结合对应单质、化合物的性质以及题目要求解答该题.
解答 解:A、B常温下均为无色液体,且均由两种相同的元素组成,A生成B和C,C为气体,一般为H2O2生成H2O的反应,则A为H2O2,B为H2O,C为O2,G为黄绿色气体,应为Cl2,D是应用最广泛的金属,应为Fe,由转化关系可知F为H2,H为HCl,E为Fe3O4,J为FeCl3,I为FeCl2,
(1)由以上分析可知A为H2O2,故答案为:H2O2;
(2)H为HCl,为共价化合物,电子式为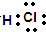 ,故答案为:
,故答案为: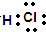 ;
;
(3)B为H2O,可在电解的条件下生成氧气和氢气,方程式为2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑,故答案为:2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑;
(4)J为FeCl3,I为FeCl2,FeCl3与Fe反应生成FeCl2,离子方程式为2Fe3++Fe=3Fe2+,故答案为:2Fe3++Fe=3Fe2+.
点评 本题考查无机物的推断,为高频考点,侧重考查元素化合物知识的综合理解和运用,把握过氧化氢、铁等物质的性质及其转化、电解原理等为解答的关键,注意A、B、J为解答的突破口,综合性较强,题目难度中等.

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目
10.用中和滴定法测定某烧碱样品的纯度,若烧碱中含有不反应的杂质,试根据实验回答:
(1)将准确称好的5.0g烧碱样品配成250mL待测液,需要的主要仪器除量筒、烧杯、玻璃棒、胶头滴管处,还必须用到的玻璃仪器有250mL容量瓶.
(2)取待测液10.00mL,需用碱式滴定管(填仪器名称)量取,并置于锥形瓶中.
(3)向锥形瓶中滴加两滴指示剂,用0.200mol/L HCl溶液滴定烧碱溶液.不适宜选用的指示剂为(选序号填):①.
①石蕊溶液 ②酚酞溶液 ③甲基橙溶液
(4)滴定操作的要领是:左手握活塞,右手摇锥形瓶,眼睛要注视锥形瓶中溶液颜色的变化.
(5)根据下表实验数据,可计算出烧碱的纯度为80%.
(6)下列操作会使所测溶液的浓度数值偏高的是(填代号)AC.
A.酸式滴定管未用HCl溶液润洗就直接注入HCl溶液
B.锥形瓶用蒸馏水洗净后没有干燥就注入NaOH待测液
C.装有HCl溶液的酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取HCl溶液体积时,开始仰视读数,滴定结束后俯视读数.
(1)将准确称好的5.0g烧碱样品配成250mL待测液,需要的主要仪器除量筒、烧杯、玻璃棒、胶头滴管处,还必须用到的玻璃仪器有250mL容量瓶.
(2)取待测液10.00mL,需用碱式滴定管(填仪器名称)量取,并置于锥形瓶中.
(3)向锥形瓶中滴加两滴指示剂,用0.200mol/L HCl溶液滴定烧碱溶液.不适宜选用的指示剂为(选序号填):①.
①石蕊溶液 ②酚酞溶液 ③甲基橙溶液
(4)滴定操作的要领是:左手握活塞,右手摇锥形瓶,眼睛要注视锥形瓶中溶液颜色的变化.
(5)根据下表实验数据,可计算出烧碱的纯度为80%.
| 滴定次数 | 待测液体积(mL) | HCl溶液体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 10.00 | 0.50 | 20.51 |
| 第二次 | 10.00 | 4.00 | 24.00 |
| 第三次 | 10.00 | 5.11 | 25.10 |
A.酸式滴定管未用HCl溶液润洗就直接注入HCl溶液
B.锥形瓶用蒸馏水洗净后没有干燥就注入NaOH待测液
C.装有HCl溶液的酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取HCl溶液体积时,开始仰视读数,滴定结束后俯视读数.
11.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 1.0 mol•L-1 KNO3溶液:H+、Fe2+、SCN-、SO42- | |
| B. | 水电离出的c(H+)=10-10 mol•L-1的溶液:K+、Ba2+、NO3-、Cl- | |
| C. | pH=0的溶液:Al3+、Ag(NH3)2+、Cl-、SO42- | |
| D. | c(ClO-)=1.0 mol•L-1的溶液:Na+、SO32-、S2-、SO42- |
8.下列有关氯气的说法正确的是( )
| A. | 氯气是黄绿色气体,有毒,有刺激性气味,氯水还可杀菌消毒 | |
| B. | 液氯就是氯气的水溶液,它能使干燥的有色布条褪色 | |
| C. | 红热的铁丝在Cl2中燃烧产生棕色的雾;H2在Cl2中燃烧火焰呈淡蓝色 | |
| D. | 氯水长时间放置会变质,是因为氯气几乎完全挥发,剩下的就是水. |
15.下列物质中既有离子键又有共价键的是( )
| A. | CaO | B. | CO2 | C. | K2O | D. | Ca(OH )2 |
12.下表列出了①~⑨九种元素在周期表中的位置:
请按要求回答下列问题.
(1)化学性质最不活泼的元素的原子结构示意图为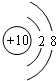
(2)⑥④⑦的氢化物的稳定性最强的是:H2O(写氢化物的化学式);
(3)元素③④⑤形成的离子半径由大到小的顺序是N3->O2->Na+(用离子符号表示)
(4)用电子式表示元素⑤与⑦的化合物的形成过程: .
.
| ⅠA | Ⅷ | ||||||
| ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| ② | ③ | ④ | ⑧ | ||||
| ⑤ | ⑥ | ⑦ | ⑨ | ||||
(1)化学性质最不活泼的元素的原子结构示意图为
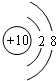
(2)⑥④⑦的氢化物的稳定性最强的是:H2O(写氢化物的化学式);
(3)元素③④⑤形成的离子半径由大到小的顺序是N3->O2->Na+(用离子符号表示)
(4)用电子式表示元素⑤与⑦的化合物的形成过程:
 .
.
9.25℃,pH=2的 HC1溶液中,由水电离出的c(H+)是( )
| A. | 1×10-7 mol/L | B. | 1×10-12mol/L | C. | 1×10-2 mol/L | D. | 1×10-7 mol/L |
 合成氨工业对工、农业生产和国防都有重要意义.
合成氨工业对工、农业生产和国防都有重要意义. 二甲醚(CH3OCH3)被称为21世界的新型燃料,在未来可能替代汽油、液化气、煤气等并具有优良的环保性能.工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应:
二甲醚(CH3OCH3)被称为21世界的新型燃料,在未来可能替代汽油、液化气、煤气等并具有优良的环保性能.工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应: